Diprospan 5,0mg/mL + 2,0mg/mL, caixa com 1 seringa com 1mL de suspensão de uso intramuscular + agulha
Cosmed

Diprospan 5,0mg/mL + 2,0mg/mL, caixa com 1 seringa com 1mL de suspensão de uso intramuscular + agulha
CosmedBranca Comum (Venda Sob Prescrição Médica)
Não pode ser partido
Temperatura ambiente
Bula do Diprospan
Diprospan® está indicado para o tratamento de doenças agudas e crônicas que respondem aos corticoides.
A terapia hormonal com corticosteroide é coadjuvante e não substitui a terapêutica convencional.
Diprospan® é indicado para os seguintes quadros clínicos:
Alterações osteomusculares e de tecidos moles
- Artrite reumatoide, doenças das articulações como: osteoartrite, bursite, espondilite anquilosante, espondilite radiculite, dor no cóccix, ciática, dor nas costas, torcicolo, exostose, inflamação na planta dos pés (fascite).
Condições alérgicas
- Asma, rinite alérgica devida a pólen, edema angioneurótico (inchaço que pode afetar várias partes do organismo), bronquite alérgica, rinite alérgica persistente, hipersensibilidade à drogas, doença do soro, picadas de insetos.
Condições dermatológicas
- Dermatite atópica (doença alérgica da pele), líquen simples crônico, dermatite de contato, dermatite solar grave, urticária, líquen plano hipertrófico, necrobiose lipoídica associada com diabetes mellitus (espécie de úlcera que afeta diabéticos), alopecia areata (queda de cabelo), Lúpus Eritematoso Discoide, psoríase, queloides, pênfigo, dermatite herpetiforme.
Doenças do colágeno
- Lúpus Eritematoso Sistêmico, esclerodermia, dermatomiosite, poliarterite nodosa (tipos de doenças autoimunes).
Tumores malignos
- Para o tratamento paliativo de leucemias e linfomas em adultos, leucemia aguda da infância.
Outras condições
- Síndrome adrenogenital (alteração hormonal que pode masculinizar as mulheres), doenças gastrintestinais como: colite ulcerativa, ileíte regional, doença celíaca; afecções dos pés (bursite, hallux rigidus, 5º dedo varo), afecções necessitando de injeções subconjuntivais, transtornos hematológicos que respondem aos corticosteroides, alterações dos rins como: síndrome nefrítica e síndrome nefrótica.
A insuficiência adrenocortical primária ou secundária poderá ser tratada com Diprospan®, mas deverá haver suplementação com mineralocorticoides.
Diprospan® é recomendado para:
- Injeções intramusculares para doenças que respondem aos corticoides sistêmicos;
- Injeções diretamente nos tecidos moles afetados, quando indicado;
- Injeções intra-articulares e periarticulares em artrites;
- Injeções intralesionais para várias condições dermatológicas e;
- Injeções locais para certos transtornos inflamatórios e císticos dos pés.
Diprospan® é uma associação de ésteres de betametasona que produzem efeito anti-inflamatório, antialérgico a antirreumático.
A ação imediata é fornecida pelo fosfato dissódico de betametasona, que é rapidamente absorvido após a administração. A ação prolongada é promovida pelo dipropionato de betametasona que, por ser de absorção lenta, controla os sintomas durante longo período de tempo. O tamanho reduzido do cristal de dipropionato de betametasona permite o uso de agulha de fino calibre (até calibre 25) para administração intradérmica e intralesional.
Diprospan® é uma suspensão aquosa injetável estéril de dipropionato de betametasona e fosfato dissódico de betametasona. Cada mL de Diprospan® contém 5mg de betametasona como dipropionato e 2mg de betametasona como fosfato dissódico, em veículo estéril tamponado e conservado.
Os glicocorticoides, como a betametasona, causam profundos e variados efeitos metabólicos e modificam a resposta imunológica do organismo à diversos estímulos.
Este medicamento é contraindicado para pacientes que já tiveram qualquer alergia ou alguma reação incomum como hipersensibilidade ao dipropionato de betametasona, fosfato dissódico de betametasona, a outros corticoides ou a qualquer um dos componentes da fórmula. Também é contraindicado em pacientes com infecções sistêmicas por fungos.
Diprospan® não deverá ser administrado por via intramuscular em pacientes com púrpura trombocitopênica idiopática.
Este medicamento é contraindicado para menores de 15 anos.
Para administração intramuscular, intra-articular, periarticular, intrabúrsica, intradérmica, intralesional e em tecidos moles.
Não está indicado para uso intravenoso ou subcutâneo. Este produto só poderá ser injetado por via intramuscular profunda na região glútea usando exclusivamente agulha calibre 30/7.
Por se tratar de uma suspensão injetável, o Diprospan® deve ser aplicado por um profissional de saúde.
Agite antes de usar. Técnica estritamente asséptica é mandatória para o uso do produto.
Instruções de uso do conjunto seringa e agulha com sistema de segurança
- Se a agulha já estiver previamente conectada, puxe para trás o dispositivo de segurança azul;
- Caso a agulha não esteja conectada, conecte-a à seringa com firmeza;
- Se precisar girar o dispositivo de segurança para orientar o bisel ou ler a escala, segure o dispositivo azul de segurança no ponto em que ele se conecta com a seringa com uma das mãos e gire a seringa com a outra mão;
- Remova o protetor da agulha e realize o procedimento de aspiração da suspensão de Diprospan® da ampola normalmente;
Atenção: Não use as duas mãos para fechar o dispositivo azul de segurança após aplicação.
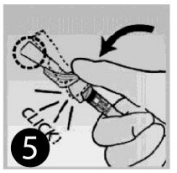
- Após a aplicação, empurre o dispositivo azul com o dedo;
- Continue a apertar até que a agulha esteja totalmente coberta pelo dispositivo e o dispositivo esteja travado. Você ouvirá um clique quando o dispositivo de segurança azul estiver travado. Confirme visualmente se a agulha está coberta;
- Aperte o êmbolo para quebra-lo, impedindo assim a sua reutilização;
- Após o único uso, descarte o conjunto agulha + seringa imediatamente num recipiente aprovado para objetos cortantes, conforme normas de segurança.
Advertências
A quebra do dispositivo pode causar respingos. Assegure-se de que a seringa esteja vazia antes de quebrar o êmbolo. Para maior segurança, ao quebrar o êmbolo, segure a seringa voltada para baixo, longe de si próprio e dos outros.
Caso o êmbolo quebre prematuramente durante a injeção, continue a apertá-lo até que a dose seja completamente administrada.
Instruções de uso (conjunto Hypak®)
Abertura do blister
- Puxe o alumínio pelo lado indicado na ilustração abaixo;
- A seguir, veja as instruções de montagem.
Montagem do conjunto Hypak®
- Enrosque a haste do êmbolo de borracha do sistema Hypak® esterilizado, descartável;
- Com a seringa na vertical, retire o protetor de borracha e adapte a agulha esterilizada. Retire o protetor da agulha e expulse o ar.
Uso da agulha com dispositivo de segurança
- Com a agulha previamente conectada à seringa, puxe para trás o dispositivo de segurança cor-de-rosa;
- Remova o protetor da agulha e realize o procedimento empregando a técnica usual;
- Não use as duas mãos para ativar o dispositivo de segurança;
- Para ativar o dispositivo de segurança, utilizando apenas uma mão, empurre o dispositivo rosa com o dedo polegar;
- Você ouvirá um "clique" quando o dispositivo de segurança estiver travado. Confirme visualmente se a agulha está protegida;
- Depois de uma única utilização, descarte em um coletor de perfurocortantes aprovado de acordo com as regulamentações e políticas institucionais.
Atenção: O produto depois de aberto não pode ser reutilizado. O conteúdo restante não deve ser utilizado em outras aplicações. Caso houver sobra, seu conteúdo deve ser descartado.
A seringa após a aplicação não deve ser reutilizada. Deve ser descartada em recipiente apropriado.
Informe seu médico o aparecimento de reações desagradáveis, como alterações osteomusculares, gastrintestinais, dermatológicas, neurológicas, psiquiátricas, hiper ou hipopigmentação, atrofia cutânea e subcutânea, abscessos estéreis, rubor local pós-injeção (em seguida ao uso intra-articular).
As necessidades posológicas são variáveis e deverão ser individualizadas com base na doença específica, na gravidade do quadro e na resposta do paciente ao tratamento.
A dose inicial deverá ser mantida ou ajustada até que uma resposta satisfatória seja obtida. Se uma resposta clínica satisfatória não ocorrer após um período de tempo razoável, o tratamento com Diprospan® deverá ser descontinuado e deverá ser iniciada outra terapia apropriada.
Administração sistêmica
- Para o tratamento sistêmico, Diprospan® deverá ser iniciado com 1 a 2mL na maioria das condições, repetindo-se a terapia, quando necessário. A administração é através de injeção intramuscular (IM) profunda na região glútea. A dosagem e a frequência das administrações irão depender da gravidade da condição do paciente e da resposta terapêutica. Em doenças graves, como lúpus eritematoso sistêmico ou estado de mal asmático já controlados por medidas de emergência, 2mL poderão ser necessários inicialmente.
- Grande variedade de condições dermatológicas respondem à administração IM de corticoides. Uma injeção de 1mL, repetida de acordo com a resposta terapêutica, foi considerada como eficaz.
- Em doenças do trato respiratório, o início da melhora dos sintomas ocorre dentro de poucas horas após a Injeção Intramuscular de Diprospan®. O controle efetivo dos sintomas com 1 a 2mL é obtido na asma brônquica, febre do feno, bronquite alérgica e rinite alérgica.
- No tratamento da bursite aguda ou crônica, resultados excelentes foram obtidos com 1 a 2mL de Diprospan® administrados por via intramuscular, repetidos se necessário.
Administração local
- O uso de anestésicos locais raramente é necessário. Se isto for desejável, Diprospan® poderá ser misturado (na seringa e não no frasco) com lidocaína ou procaína 1% a 2% ou anestésicos locais similares. Devem ser evitadas formulações que contenham metilparabeno, propilparabeno e fenol.
- A dose necessária de Diprospan® é transferida para a seringa e, em seguida, o anestésico. A mistura na seringa deve ser agitada levemente.
- Em bursites agudas subdeltoides, subcromiais, olecraniais e pré-patelares, uma injeção intrabúrsica de 1 a 2mL de Diprospan® poderá aliviar a dor e restaurar a completa movimentação dentro de poucas horas. A bursite crônica poderá ser tratada com doses reduzidas, assim que os sintomas agudos estejam controlados. Em tenossinovite aguda, tendinite e peritendinite, uma injeção de Diprospan® poderá trazer alívio. Em formas crônicas destas doenças, poderão ser necessárias injeções repetidas, de acordo com as necessidades do paciente.
- Após administração intra-articular de 0,5mL a 2mL de Diprospan® ocorre alívio da dor, da sensibilidade e rigidez associadas à osteoartrite e à artrite reumatoide dentro de 2 a 4 horas. A duração do alívio, que varia amplamente nas duas condições, é de 4 semanas ou mais, na maioria dos casos.
Uma injeção intra-articular de Diprospan® é bem tolerada pela articulação e pelos tecidos periarticulares. As doses recomendadas para injeção intra-articular são:
Grandes articulações (joelho, bacia, ombro)
- 1 – 2mL.
Médias articulações (cotovelo, punho, tornozelo)
- 0,5 – 1mL.
Pequenas articulações (pé, mão, tórax)
- 0,25 – 0,5mL.
Afecções dermatológicas poderão responder à administração intralesional de Diprospan®. A resposta de algumas lesões não tratadas diretamente poderá ser devida à um leve efeito sistêmico do fármaco. No tratamento intralesional, é recomendada uma dose intradérmica de 0,2mL/cm² de Diprospan® distribuída igualmente com uma seringa do tipo tuberculina e agulha de calibre 26. A quantidade total de Diprospan® aplicada em todas as áreas não deverá exceder 1mL por semana.
Diprospan® poderá ser usado eficazmente em afecções do pé que sejam suscetíveis aos corticoides. Bursite sob heloma (espessamento de uma das camadas da pele) duro ou mole poderá ser controlada com duas injeções sucessivas, de 0,25mL cada. Em algumas condições, como hallux rigidus, 5º dedo varo e artrite gotosa aguda, a melhora dos sintomas poderá ser rápida. Uma seringa do tipo tuberculina e uma agulha de calibre 25 são adequadas para a maioria das injeções.
As doses recomendadas, em intervalos de aproximadamente uma semana, são:
- Bursite sob heloma duro ou mole, 0,25mL – 0,5mL;
- Bursite sob esporão de calcâneo, 0,5mL;
- Bursite sobre hallux rigidus, 0,5mL;
- Bursite sobre o 5º dedo varo, 0,5mL;
- Cisto sinovial, 0,25mL – 0,5mL;
- Neuralgia de Morton (metatarsalgia), 0,25mL – 0,5mL;
- Tenossinovite, 0,5mL;
- Periostite do cuboide, 0,5mL;
- Artrite gotosa aguda, 0,5mL – 1mL.
Depois de obtida uma resposta favorável, a dosagem de manutenção deverá ser determinada através da diminuição da dose inicial em decréscimos graduais, a intervalos apropriados, até que seja encontrada a dose mínima capaz de manter uma resposta clínica adequada.
A exposição do paciente à situações de estresse não relacionadas à doença em curso poderá necessitar de aumento da dose de Diprospan®. Se for necessária a descontinuação do fármaco após tratamento prolongado, a dose deverá ser reduzida gradualmente.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Informe seu médico o aparecimento de reações desagradáveis, como alterações osteomusculares, gastrintestinais, dermatológicas, neurológicas, psiquiátricas, hiper ou hipopigmentação, atrofia cutânea e subcutânea, abcessos estéreis, rubor local pós-injeção (em seguida ao uso intra-articular).
Por se tratar de um corticosteroide de administração parenteral, que deve ser administrado por um profissional habilitado de saúde, a possibilidade de esquecimento de dose é remota. Em caso de esquecimento, programe-se para administrar o medicamento assim que possível.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Diprospan® não deverá ser usado por via intravenosa ou subcutânea. Técnica estritamente asséptica é mandatória com uso de Diprospan®.
Agite antes de usar.
Por se tratar de uma suspensão injetável, o Diprospan® deve ser aplicado por um profissional de saúde.
Diprospan® contém dois ésteres de betametasona, um dos quais, o fosfato dissódico de betametasona, desaparece rapidamente do local da injeção. O potencial para efeitos sistêmicos produzidos por esta porção solúvel de Diprospan® deverá ser considerada pelo médico ao usar este preparado.
Após a administração intra-articular deverão ser tomadas precauções pelo paciente para evitar o uso excessivo da articulação na qual foi obtido benefício sintomático.
A administração intramuscular de corticoides deverá ser feita profundamente em grandes massas musculares para evitar atrofia tissular local.
As injeções em tecidos moles, intralesionais e intra-articulares podem produzir efeitos sistêmicos e locais.
É necessário o exame do líquido sinovial para excluir um processo infeccioso. Deve-se evitar a injeção local em uma articulação previamente infectada. O aumento da dor e do edema local, restrição maior dos movimentos articulares, febre e mal-estar são sugestivos da artrite séptica. Se a infecção for confirmada, deverá ser instituída terapia antimicrobiana apropriada.
Corticosteroides não deverão ser injetados em articulações não estáveis, áreas infectadas ou espaços intervertebrais. Injeções repetidas em articulações com osteoartrite podem aumentar a destruição articular. Evitar injetar corticosteroides diretamente nos tendões devido à relatos de ruptura tardia do tendão.
Devido à ocorrência de raros casos de reações anafiláticas com o uso parenteral de corticoides, deverão ser tomadas medidas apropriadas de precaução antes da administração, especialmente se o paciente apresentar histórico de alergia medicamentosa.
Com o tratamento prolongado, deverá ser considerada a transferência da administração parenteral para a oral, depois da avaliação dos potenciais benefícios e riscos.
Reajustes posológicos poderão ser necessários para remissões ou exacerbações do processo patológico, conforme a resposta individual de cada paciente sob tratamento e quando ocorrer exposição do paciente à situações de estresse, isto é, infecção grave, cirurgia ou traumatismo. Após o término de um tratamento prolongado com corticoides em altas doses, poderá ser necessária monitorização por até um ano.
Os corticoides podem mascarar sinais de infecção e novas infecções podem surgir durante o seu uso.
Quando os corticoides são usados, pode ocorrer diminuição da resistência e dificuldade de localizar o sítio de uma nova infecção.
O uso prolongado de corticoides pode produzir catarata subcapsular posterior, especialmente em crianças, glaucoma com possível dano ao nervo óptico, podendo ocorrer aumento da incidência de infecções oculares secundárias devidas à fungos ou vírus.
Altas doses de corticoides podem causar elevação da pressão arterial e retenção hidrossalina, assim como aumento da excreção de potássio. Esses efeitos ocorrem com menos frequência com os derivados sintéticos, exceto quando usados em altas doses.
Deve ser considerada uma dieta com restrição de sal e suplementação de potássio. Todos os corticoides aumentam a excreção de cálcio.
Enquanto em tratamento com corticosteroide, os pacientes não deverão ser vacinados contra varíola.
Alguns procedimentos de imunização não deverão ser realizados em pacientes recebendo corticosteroides, principalmente em altas doses, devido ao provável risco de complicações neurológicas e falta de resposta por anticorpos. Quando o corticosteroide estiver sendo utilizado como terapia de reposição (Ex.: Doença de Addison), os procedimentos de imunização poderão ser realizados normalmente.
Pacientes em uso de doses imunossupressoras de corticosteroides deverão ser alertados a evitar a exposição à pessoas portadoras de varicela ou sarampo, e, se forem expostas, deverão procurar orientação médica, principalmente no caso de crianças.
O tratamento com corticosteroides em pacientes com tuberculose ativa deverá ser restrito aos casos de tuberculose fulminante ou disseminada, nos quais o corticosteroide é usado em associação com um esquema antituberculoso apropriado.
Se os corticoides forem indicados em pacientes com tuberculose latente ou com reatividade tuberculina, será necessária uma observação cuidadosa, uma vez que poderá ocorrer reativação da doença. Durante tratamento prolongado, estes pacientes deverão receber quimioprofilaxia. O uso da rifampicina no programa de quimioprofilaxia, devido ao seu efeito de estimulação da depuração dos glicocorticoides, poderá impor um reajuste na dose empregada.
A menor dose possível de corticoide deverá ser usada para controlar a condição sob tratamento. Quando a redução da dose for possível, deverá ser gradual.
Insuficiência adrenocortical secundária, induzida pelo medicamento, poderá resultar da retirada muito rápida do corticoide, podendo ser minimizada pela redução gradual da dose. Essa insuficiência poderá persistir por meses após a descontinuação do tratamento, portanto, se ocorrer estresse durante este período, a corticoterapia deverá ser reinstituída. Se o paciente já estiver recebendo corticosteroides, a dose deverá ser aumentada. Uma vez que a secreção mineralocorticoide pode estar prejudicada, devem ser administrados sal e/ou mineralocorticosteroides concomitantemente.
Os efeitos dos corticoides são aumentados em pacientes com hipotireoidismo e em pacientes com cirrose hepática.
Aconselha-se cautela ao se usar corticoides em pacientes com herpes simples ocular devido à possibilidade de perfuração da córnea.
Podem ocorrer transtornos psíquicos com a terapia corticosteroide. Os corticoides podem agravar instabilidade emocional ou tendências psicóticas preexistentes.
Corticoides deverão ser usados com cautela em colite ulcerativa não especificada, quando houver probabilidade de perfuração iminente, abscesso ou outra infecção piogênica, em diverticulite, anastomose intestinal recente, úlcera péptica ativa ou latente, insuficiência renal, hipertensão arterial, osteoporose e miastenia gravis.
Como as complicações do tratamento com corticosteroides são dependentes da dose e duração do tratamento, uma decisão baseada na relação risco/benefício deverá ser tomada para cada caso individual.
O crescimento e desenvolvimento de crianças e lactentes fazendo uso prolongado de corticoides deverão ser acompanhados cuidadosamente, pois pode haver distúrbio no crescimento e inibição da produção endógena de cortisol.
O tratamento com corticosteroides pode alterar a motilidade e o número de espermatozoides.
A administração intra-articular e/ou intralesional pode produzir efeitos sistêmicos e locais, o que deverá ser levado em consideração em pacientes tratados concomitantemente com corticosteroides oral e/ou parenteral.
Uso durante a gravidez e lactação
Como não foram feitos estudos controlados de reprodução humana com corticosteroides, o uso de Diprospan® durante a gravidez ou em mulheres em idade fértil exige que os possíveis benefícios do fármaco sejam pesados contra os potenciais riscos para a mãe, o feto e o lactente. Crianças nascidas de mães que receberam doses substanciais de corticoides durante a gestação deverão ser observadas cuidadosamente para a detecção de sinais de hipoadrenalismo.
Devido à possibilidade de surgirem efeitos adversos indesejáveis com o uso do Diprospan® em lactentes, deverá ser tomada a decisão de descontinuar a amamentação ou o tratamento, levando-se em consideração a importância do medicamento para a mãe.
Informe seu médico a ocorrência de gravidez na vigência do tratamento ou após o seu término. Informe ao médico se você estiver amamentando.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Este medicamento pode causar doping.
Reações adversas a Diprospan®, como aos demais corticosteroides, estão relacionadas com a posologia e a duração do tratamento. Geralmente estas reações podem reverter-se ao mínimo com a redução da posologia, o que é geralmente preferível à suspensão do tratamento farmacológico.
Embora a incidência de reações adversas a Diprospan® seja baixa, a possível ocorrência de efeitos colaterais conhecidos dos corticoides deverá ser considerada.
As reações adversas relacionadas ao uso de Diprospan®, de acordo com a frequência de ocorrência e o sistema acometido são:
Reações comuns (ocorrem entre 1% e 10% dos pacientes que utilizam este medicamento)
- Sistema Nervoso Central: insônia;
- Sistema gastrintestinal: dispepsia; aumento de apetite;
- Organismo como um todo: aumento da incidência de infecções.
Reações incomuns (ocorrem entre 0,1% e 1% dos pacientes que utilizam este medicamento)
- Pele: dificuldade de cicatrização; pequenos vasos superficiais visíveis; infecções subcutâneas; pele fina e frágil; inflamação do folículo piloso; coceira;
- Sistema endócrino: diabetes mellitus; Síndrome de Cushing (estado decorrente do excesso de corticoide);
- Sistema musculoesquelético: osteoporose;
- Sistema gastrintestinal: sangramento digestivo;
- Sistema geniturinário: redução de potássio no sangue; retenção de sódio e água; irregularidade menstrual.
Reações raras (ocorrem entre 0,01% e 0,1% dos pacientes que utilizaram este medicamento)
- Pele: estrias; hematomas; reação de hipersensibilidade; espinhas; urticária; sudorese excessiva; rash cutâneo; vermelhidão da face e pescoço após aplicação; sintomas e sinais no local de aplicação; aumento de pelos; diminuição da pigmentação cutânea;
- Sistema Nervoso Central: depressão; convulsões; tontura; cefaleia; confusão mental; euforia; distúrbio de personalidade; alteração de humor;
- Sistema gastrintestinal: úlcera péptica com possível perfuração e hemorragia; aumento do tamanho do fígado; distensão abdominal; alteração em exames do fígado;
- Sistema geniturinário: diminuição da contagem de espermatozoides;
- Sistema musculoesquelético: lesão muscular induzida por corticoide; fraqueza muscular; dor muscular;
- Olhos: aumento de pressão intraocular; catarata;
- Sistema cardiovascular: pressão alta; arritmias cardíacas; insuficiência cardíaca congestiva; edema agudo do pulmão; trombose venosa profunda; vasculite;
- Organismo como um todo: ganho de peso; infecção por fungos.
Reações cuja incidência não está determinada
- Soluços, alcalose hipocalêmica (aumento do pH do sangue por falta de potássio), perda de massa muscular, fraturas, necrose asséptica da cabeça do fêmur e do úmero, fratura patológica dos ossos longos, ruptura de tendão, instabilidade articular decorrente de repetidas injeções intra-articulares, pancreatite, esofagite ulcerativa, adelgaçamento cutâneo, petéquias e equimose, eritema (vermelhidão) facial, diminuição ou supressão da reação aos testes cutâneos, edema angioneurótico, aumento da pressão intracraniana com edema de papila (pseudotumor cerebral), diminuição do crescimento na infância e no período intrauterino, falta de resposta adrenocortical e pituitária, diminuição da tolerância aos carboidratos, manifestações clínicas de diabetes mellitus latente, aumento das necessidades diárias de insulina ou agentes hipoglicemiantes orais em diabéticos, glaucoma, balanço nitrogenado negativo devido ao catabolismo proteico, manifestações psicóticas, reações anafiláticas, hipotensão, choque, dermatite alérgica, exoftalmia, agravamento dos sintomas na miastenia gravis.
Reações adversas relacionadas ao tratamento corticoide parenteral incluem:
- Casos raros de cegueira associados ao tratamento intralesional da face e da cabeça; hiper ou hipopigmentação, atrofia cutânea e subcutânea; abscessos estéreis; área de rubor pós-injeção (em seguida ao uso intra-articular); artropatia do tipo Charcot.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
Suspensão injetável 5mg/mL + 2mg/mL
- Embalagem contendo 1 ampola de 1mL acompanhado de seringa descartável esterilizada.
- Embalagem contendo 1 seringa Hypak® esterilizada preenchida com 1mL.
- Embalagem contendo 6 ampolas de 1mL.
Via de administração: injetável (intramuscular, intra-articular, periarticular, intrabúrsica, intradérmica, intralesional e em tecidos moles).
Uso adulto e pediátrico acima de 15 anos.
Cada mL da suspensão injetável contém:
|
Dipropionato de betametasona (equivalente a 5mg de betametasona) |
6,43 mg |
|
Fosfato dissódico de betametasona (equivalente a 2mg de betametasona) |
2,63 mg |
|
Veículo q.s.p |
1 mL |
Veículo: fosfato de sódio dibásico, cloreto de sódio, edetato dissódico, polissorbato 80, álcool benzílico, metilparabeno, propilparabeno, carmelose sódica, macrogol e água.
Sintomas
A superdose aguda de corticosteroides não leva à situações de risco de vida. Exceto nos casos de doses muito elevadas, alguns dias de dosagem excessiva não parecem produzir resultados prejudiciais na ausência de contraindicações específicas, como em pacientes com diabetes mellitus, glaucoma, úlcera péptica ativa ou em pacientes que estejam fazendo uso de medicamentos como digitálicos, anticoagulantes cumarínicos ou diuréticos depletores de potássio.
Tratamento
Complicações resultantes dos efeitos metabólicos dos corticosteroides ou dos efeitos deletérios da doença de base, ou concomitante, ou resultante de interações medicamentosas deverão ser tratadas apropriadamente.
Manter ingestão adequada de líquidos e monitorizar os eletrólitos séricos e urinários, com especial atenção ao balanço de sódio e potássio. Tratar o desequilíbrio eletrolítico, se necessário.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Interações medicamento-medicamento
O uso concomitante de fenobarbital, rifampicina, fenitoína ou efedrina pode aumentar o metabolismo do corticosteroide, reduzindo, assim, seus efeitos terapêuticos.
Pacientes que estejam recebendo corticosteroides e estrogênios concomitantemente deverão ser observados devido à possível ocorrência de exacerbação dos efeitos dos corticosteroides.
O uso concomitante de corticosteroides com diuréticos depletores de potássio pode aumentar a hipocalemia (diminuição de potássio no sangue).
O uso concomitante de corticoides com glicosídeos cardíacos pode aumentar a possibilidade de arritmias ou intoxicação digitálica associada à hipocalemia.
Os corticoides podem aumentar a depleção de potássio causada pela anfotericina B. Em todos os pacientes em uso de digitálicos, diuréticos depletores de potássio e anfotericina B, as concentrações dos eletrólitos séricos, principalmente os níveis de potássio, deverão ser monitorizadas cuidadosamente.
O uso concomitante de corticosteroides com anticoagulantes cumarínicos pode aumentar ou diminuir os efeitos anticoagulantes, havendo necessidade de ajustes posológicos.
Os corticosteroides podem diminuir as concentrações sanguíneas dos salicilatos. O ácido acetilsalicílico deve ser utilizado com cuidado em associação aos corticosteroides em pacientes com hipoprotrombinemia (alteração sanguínea que altera a coagulação do sangue). Quando os corticosteroides forem administrados à diabéticos, poderão ser necessários reajustes posológicos dos hipoglicemiantes orais e da insulina.
Terapia concomitante com glicocorticoides pode inibir a resposta à somatotropina.
Interações medicamento-álcool
Os efeitos combinados de anti-inflamatórios não esteroides ou álcool com corticoides podem resultar em aumento da ocorrência ou da gravidade de ulcerações gastrintestinais.
Interações medicamento-exames laboratoriais
Os corticoides podem afetar o teste de “nitroblue tetrazolium” para infecção bacteriana e produzir resultados falso-negativos.
Informe ao seu médico ou cirurgião-dentista se você estiver fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para sua saúde.
Resultados de Eficácia
Asma
Jacyna e colaboradores realizaram um estudo aberto envolvendo 30 pacientes com asma brônquica. Os pacientes receberam doses intramusculares de 1 a 2mL de Dipropionato de Betametasona + Fosfato Dissódico de Betametasona (5mg de dipropionato de betametasona mais 2mg de fosfato de betametasona por mL) e foram avaliados semanalmente durante 6 semanas. Observou-se alívio dos sintomas de asma já do primeiro ao segundo dia da aplicação em 73% dos pacientes. Além disso, 40% dos pacientes ficaram livres de recidivas durante as seis semanas de acompanhamento. Não foram relatados eventos adversos neste estudo de curta duração.1
Ljaljevic e colaboradores compararam os efeitos de uma dose única de 1mL de Dipropionato de Betametasona + Fosfato Dissódico de Betametasona (5mg de dipropionato de betametasona mais 2mg de fosfato de betametasona) com uma dose de 1mL de acetato de metilprednisolona (40mg), ambas por via intramuscular, em pacientes com asma crônica. O tempo para início do alívio dos sintomas foi igual nos dois grupos (2,4 dias). Contudo, os pacientes alocados para o tratamento com Dipropionato de Betametasona + Fosfato Dissódico de Betametasona tiveram maior duração de alívio dos sintomas (27 dias versus 8,5 dias para o grupo acetato de metilprednisolona, P< 0,002). Consequentemente, aquele grupo necessitou de número maior de injeções para o controle dos sintomas durante o período do estudo de seis semanas (1,1 versus 2,4 injeções, P< 0,002). O percentual de pacientes que respondeu positivamente foi superior no grupo Dipropionato de Betametasona + Fosfato Dissódico de Betametasona (100% versus 77,8%, P = 0,046) e a taxa de eventos adversos (cefaleia, sonolência e mal-estar) foi igual nos dois grupos.2
Mazzei e colaboradores realizaram um estudo aberto envolvendo 51 pacientes com asma brônquica com idade entre 15 e 71 anos. Cada paciente recebeu uma dose de 1 mL de Dipropionato de Betametasona + Fosfato Dissódico de Betametasona por via intramuscular (5mg de dipropionato de betametasona mais 2mg de fosfato de betametasona), após a primeira avaliação. Foram então acompanhados com visitas semanais durante 6 semanas. Resposta clínica considerada boa ou excelente foi obtida em 96% dos pacientes, sendo que 43% e 88% dos indivíduos apresentaram remissão completa dos sintomas na primeira e na segunda semana após a dose, respectivamente. A duração do efeito variou de 14 a 46 dias, com uma média de 42 dias. As reações adversas ao tratamento foram leves e passageiras (aumento de apetite e astenia).3
Doenças reumatológicas
Foi realizado um estudo duplo-cego controlado que comparou a eficácia e a segurança de injeções intraarticulares de Dipropionato de Betametasona + Fosfato Dissódico de Betametasona (5mg de dipropionato de betametasona mais 2mg de fosfato de betametasona por mL) com acetato de metilprednisolona (40mg/mL). Quarenta e nove pacientes com artrite reumatoide (idades de 27 a 73 anos) foram distribuídos aleatoriamente para tratamento com Dipropionato de Betametasona + Fosfato Dissódico de Betametasona ou acetato de metilprednisolona por injeção intra-articular. As articulações tratadas foram joelho (n=40), cotovelo (n=3), tornozelo (n=4) e ombro (n=2). Apenas 4/26 pacientes do grupo Dipropionato de Betametasona + Fosfato Dissódico de Betametasona necessitaram uma segunda aplicação após 2-3 semanas da primeira, enquanto 12/23 pacientes do grupo acetato de metilprednisolona necessitaram uma segunda dose de corticoide. Os sintomas de dor, inchaço, disfunção e limitação motora melhoraram com ambos os tratamentos, porém de forma mais pronunciada após o uso de Dipropionato de Betametasona + Fosfato Dissódico de Betametasona . Os eventos adversos relatados foram dois casos de ruborização após aplicação de Dipropionato de Betametasona + Fosfato Dissódico de Betametasona , que desapareceram após 6 horas.4
Rosenthal e colaboradores avaliaram, em estudo aberto, os efeitos da aplicação intra-articular de Dipropionato de Betametasona + Fosfato Dissódico de Betametasona para pacientes com afecções inflamatórias dos joelhos. Quarenta e um pacientes com artrite aguda no joelho foram submetidos a aplicação intra-articular de Dipropionato de Betametasona + Fosfato Dissódico de Betametasona sem anestésico local. Melhora considerável e moderada ocorreram em 46,3% e 21,9% dos pacientes, respectivamente. Melhora leve ocorreu em 29,3% e ausência de efeito em apenas 1 paciente (2,4%). Foi observado alívio da dor e dos sintomas em menos de 24 horas em 75% dos pacientes, que persistiu por um tempo médio de 4,34 semanas. Não foram observados eventos adversos locais em nenhum paciente. Aumento do apetite, poliúria, sintomas gástricos moderados e eritema facial foram efeitos adversos sistêmicos observados após a administração intra-articular de Dipropionato de Betametasona + Fosfato Dissódico de Betametasona . Todos os eventos adversos desapareceram espontaneamente e não necessitaram tratamento específico.5
Doenças alérgicas
A febre do feno (rinite alérgica sazonal devida a pólen) é uma afecção alérgica comum que responde ao tratamento com corticosteroides. Laursen e colaboradores compararam Dipropionato de Betametasona + Fosfato Dissódico de Betametasona intramuscular com beclometasona spray nasal e placebo num estudo duplo-cego e duplo-dummy. Trinta adultos com rinoconjuntivite sazonal foram distribuídos aleatoriamente para aplicação diária de 100μg de beclometasona spray em cada narina ou a uma aplicação intramuscular de 2mL de Dipropionato de Betametasona + Fosfato Dissódico de Betametasona (5mg de dipropionato de betametasona mais 2mg de fosfato de betametasona por mL) imediatamente antes da estação de pólen do vidoeiro. Os pacientes do grupo placebo e aqueles tratados com beclometasona spray apresentaram aumento dos sintomas de obstrução nasal, rinorreia, espirros e congestão ocular. Em contrapartida, aqueles tratados com Dipropionato de Betametasona + Fosfato Dissódico de Betametasona apresentaram redução da intensidade de todos os sintomas durante as seis semanas de acompanhamento. Em conclusão, uma única injeção de Dipropionato de Betametasona + Fosfato Dissódico de Betametasona imediatamente antes da estação de pólen foi superior ao tratamento com corticosteroides tópicos no alívio de sintomas de rinoconjuntivite sazonal.6
Kronholm realizou um estudo em pacientes com rinoconjuntivite alérgica sazonal, que foram distribuídos aleatoriamente para tratamento com Dipropionato de Betametasona + Fosfato Dissódico de Betametasona (10mg de dipropionato de betametasona mais 4mg de fosfato de betametasona por via intramuscular) ou acetato de metilprednisolona (80mg por via intramuscular). Ambos os tratamentos reduziram significativamente os sintomas oculares e nasais dos pacientes. Contudo, os escores de sintomas foram significativamente menores naqueles pacientes tratados com Dipropionato de Betametasona + Fosfato Dissódico de Betametasona . Nenhum paciente apresentou eventos adversos no período de observação. Em conclusão, Dipropionato de Betametasona + Fosfato Dissódico de Betametasona foi superior ao acetato de metilprednisolona no controle de sintomas de rinoconjuntivite alérgica sazonal.7
Referências Bibliográficas:
1. Jacyna K. Clinical evaluation of a new betamethasone preparation (‘Diprospan’) in the treatment of bronchial asthma. Pharmatherapeutica. 1977;1(10): 673-8.
2. Ljaljevic M. Comparison of a prolonged-acting betamethasone phosphate-dipropionate preparation (Diprospan) with methylprednisolone acetate. A trial in chronic asthmatic patients. Clinical Trials Journal. 1976; 13(4):124-8.
3. Mazzei C, Lasala FG, Ambrosio JA. Efectos del dipropionato de betametasona inyetable en el asma bronquial crônica. Inv Med Internac. 1981; 8: 263-8.
4. Sorensen K. Intraarticular treatment of rheumatoid arthritis patients with steroids: a double-blind trial of Schering 263/1 vs Depo-Medrol® . Curr Ther Res. 1978; 23(2):173-86.
5. Rosenthal M. Diprophos für die intraartikuläre therapie arthritischer affektionen. Schweiz Rundschau Med (PRAXIS). 1978; 67: 169-70.
6. Laursen LC, Faurschou P,Munch EP. Intramuscular betamethasone dipropionate vs. topical beclomethasone dipropionate and placebo in hay fever. Allergy 1988; 43 (6):420-4.
7. Kronholm A. Injectable depot cortosteroid therapy in hay fever. J Int Med Res 1979; 7(4): 314-7.
Características Farmacológicas
Dipropionato de Betametasona + Fosfato Dissódico de Betametasona é uma associação de ésteres de betametasona que produz efeito anti-inflamatório, antialérgico a antirreumático. A atividade terapêutica imediata é fornecida pelo éster solúvel, fosfato dissódico de betametasona, que é rapidamente absorvido após a administração. A atividade prolongada é promovida pelo dipropionato de betametasona que, por ser de absorção lenta, controla os sintomas durante longo período. O tamanho reduzido do cristal de dipropionato de betametasona permite o uso de agulha de fino calibre (até calibre 25) para administração intradérmica e intralesional.
Dipropionato de Betametasona + Fosfato Dissódico de Betametasona é uma suspensão aquosa injetável estéril de dipropionato de betametasona e fosfato dissódico de betametasona. Cada mL de Dipropionato de Betametasona + Fosfato Dissódico de Betametasona contém 5mg de betametasona como dipropionato e 2mg de betametasona como fosfato dissódico, em veículo estéril tamponado e conservado.
Os glicocorticoides, como a betametasona, causam profundos e variados efeitos metabólicos e modificam a resposta imunológica do organismo à diversos estímulos. A betametasona possui grande atividade glicocorticoide e pequena atividade mineralocorticoide.
Conservar em temperatura ambiente (entre 15 e 30ºC). Proteger da luz.
Mantenha a ampola no interior da caixa até o momento do uso.
Mantenha o conjunto Hypak® no interior da caixa até o momento do uso.
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Características do medicamento
Diprospan® apresenta-se como líquido levemente viscoso, contendo partículas brancas de fácil ressuspensão, límpido incolor e livre de partículas estranhas.
Após a ressuspensão o líquido apresenta-se como uma suspensão de cor branco leitosa.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Reg M.S.: nº 1.7817.0801
Farm. Responsável:
Luciana Lopes da Costa
CRF-GO nº 2.757
Registrado por:
Cosmed Indústria de Cosméticos e Medicamentos S.A
Rua Bonnard (Green Valley I) n° 980 - Bloco 12, Nível 3, Sala A
Alphaville Empresarial - Barueri - SP
CEP 06465-134 - C.N.P.J.: 61.082.426/0002-07
Indústria Brasileira
Fabricado por:
Brainfarma Indústria Química e Farmacêutica S.A
VPR 1 – Quadra 2-A – Módulo 4 – Daia
Anápolis – GO - CEP 75132-020
Venda sob prescrição médica.
Especificações sobre o Diprospan
Caracteristicas Principais
Fabricante:
Tipo do Medicamento:
Novo
Necessita de Receita:
Branca Comum (Venda Sob Prescrição Médica)
Principio Ativo:
Categoria do Medicamento:
Classe Terapêutica:
Especialidades:
Pneumologia
Alergia e Imunologia
Oncologia
Ortopedia e traumatologia
Dermatologia
Preço Máximo ao Consumidor:
PMC/SP R$ 55,55
Preço de Fábrica:
PF/SP R$ 40,18
Registro no Ministério da Saúde:
1781708010020
Código de Barras:
7891142142351
Temperatura de Armazenamento:
Temperatura ambiente
Produto Refrigerado:
Este produto não precisa ser refrigerado
Doenças Relacionadas:
Bula do Paciente:
Bula do Profissional:
Modo de Uso:
Uso injetável (intramuscular)
Pode partir:
Esta apresentação não pode ser partida
DIPROSPAN É UM MEDICAMENTO. SEU USO PODE TRAZER RISCOS. PROCURE UM MÉDICO OU UM FARMACÊUTICO. LEIA A BULA. MEDICAMENTOS PODEM CAUSAR EFEITOS INDESEJADOS. EVITE A AUTOMEDICAÇÃO: INFORME-SE COM SEU MÉDICO OU FARMACÊUTICO.
Descubra a Melhor Opção de Diprospan para Você
Compare e escolha entre variações com facilidade
 | |||
| Diprospan 5mg/mL + 2mg/mL, caixa com 1 ampola com 1mL de suspensão de uso intramuscular + seringa dosadora | Diprospan 5,0mg/mL + 2,0mg/mL, caixa com 1 seringa com 1mL de suspensão de uso intramuscular + agulha | Diprospan 5mg/mL + 2mg/mL, caixa com 6 ampolas com 1mL de suspensão de uso intramuscular | |
Dose | 5mg/mL + 2mg/mL | 5mg/mL + 2mg/mL | 5mg/mL + 2mg/mL |
Forma Farmacêutica | Suspensão injetável | Suspensão injetável | Suspensão injetável |
Quantidade na embalagem | 1 mL | 1 mL | 1 mL |
Modo de uso | Uso injetável (intramuscular) | Uso injetável (intramuscular) | Uso injetável (intramuscular) |
Substância ativa | Dipropionato de Betametasona + Fosfato Dissódico de Betametasona | Dipropionato de Betametasona + Fosfato Dissódico de Betametasona | Dipropionato de Betametasona + Fosfato Dissódico de Betametasona |
Preço Máximo ao Consumidor/SP | R$ 48,15 | R$ 55,55 | R$ 311,10 |
Preço de Fábrica/SP | R$ 34,83 | R$ 40,18 | R$ 225,04 |
Tipo do Medicamento | Novo | Novo | Novo |
Pode partir? | Este medicamento não pode ser partido | Este medicamento não pode ser partido | Este medicamento não pode ser partido |
Registro Anvisa | 1781708010012 | 1781708010020 | 1781708010071 |
Precisa de receita | Sim, precisa de receita | Sim, precisa de receita | Sim, precisa de receita |
Tipo da Receita | Branca Comum (Venda Sob Prescrição Médica) | Branca Comum (Venda Sob Prescrição Médica) | Branca Comum (Venda Sob Prescrição Médica) |
Código de Barras | 7891142142252 | 7891142142351 | 7891142982582 |