Artag
Libbs
Artag
LibbsOfertas Recomendadas
À partir de
R$
14,50
Quantidade na embalagem
Branca Comum (Venda Sob Prescrição Médica)
Bula do Artag
Artag®, coadministrado com ácido acetil salicílico (AAS), é indicado para a prevenção de eventos trombóticos (morte cardiovascular [CV], infarto do miocárdio [IM] e acidente vascular cerebral [AVC]) em pacientes adultos com Síndrome Coronariana Aguda (SCA) (angina instável [dor no peito que ocorre no repouso], infarto agudo do miocárdio sem elevação do segmento ST [IAMSST] ou infarto agudo do miocárdio com elevação do segmento ST [IAMCST]), incluindo pacientes tratados clinicamente, e aqueles que são tratados com intervenção coronária percutânea (ICP) ou cirurgia de revascularização do miocárdio (RM).
Artag®, coadministrado com ácido acetil salicílico (AAS), é indicado para a prevenção de Acidente Vascular Cerebral (AVC) (derrame) em pacientes com Acidente Vascular Cerebral Isquêmico Agudo ou Ataque Isquêmico Transitório (AIT) (bloqueio temporário do fornecimento de sangue ao cérebro, com sintomas similares ao derrame, mas durando normalmente menos de uma hora).
Artag® ajuda a impedir o acúmulo de plaquetas (células muito pequenas presentes no sangue), reduzindo a possibilidade de formação de coágulos que podem bloquear um vaso sanguíneo. Isto significa que Artag® reduz as chances de você ter outro infarto ou angina instável.
Artag® demonstra um rápido início de ação. Ocorre inibição de quase metade da capacidade de formação do coágulo cerca de 30 minutos após dose inicial, atingindo efeito máximo entre 2-4 horas pós-dose.
Você não deve tomar Artag® se tiver hipersensibilidade (alergia) ao ticagrelor ou a qualquer componente da fórmula.
Você não deve tomar este medicamento se tiver sangramento ativo, por exemplo, sangramento no estômago ou intestino devido a uma úlcera, histórico de sangramento intracraniano (dentro da cabeça) e/ou alterações graves no fígado.
Você não deve tomar estemedicamento se estiver fazendo uso concomitante com outrosmedicamentos da classe inibidores potentes do CYP3A4 (por exemplo, cetoconazol, claritromicina, nefazodona, ritonavir e atazanavir). Consulte seu médico que poderá melhor orientá-lo.
Você deve tomar os comprimidos de Artag® com água, por via oral, com ou sem a ingestão de alimentos. Para os pacientes que não conseguem engolir o comprimido inteiro, Artag® (90 mg e 2x90 mg) pode ser triturado a um pó fino e misturado em meio copo de água e ingerido imediatamente. O copo deve ser lavado com mais meio copo de água e o conteúdo deve ser ingerido. A mistura também pode ser administrada através de uma sonda nasogástrica (CH8 ou maior). É importante lavar a sonda nasogástrica com água após a administração da mistura.
Este medicamento não deve ser partido, aberto ou mastigado.
Em pacientes com Síndromes Coronarianas Agudas (SCA), o tratamento com Artag® deve ser iniciado com uma dose única de 180 mg (dois comprimidos de 90 mg) e então continuado com a dose de 90 mg duas vezes ao dia. O tratamento é recomendado por pelo menos 12 meses, exceto se a interrupção do Artag® antes desse prazo for clinicamente indicada pelo médico.
Em pacientes com Acidente Vascular Cerebral (AVC) lsquêmico Agudo ou Ataque lsquêmico Transitório (AIT), iniciar Artag® com uma dose única de 180 mg (dois comprimidos de 90 mg) e então continuar com a dose de 90 mg duas vezes ao dia por 30 dias.
Os pacientes que estiverem utilizando Artag® devem também tomar uma dose baixa de manutenção diária de 75- 150 mg de ácido acetilsalicílico. Uma dose inicial de ataque de ácido acetilsalicílico é recomendada em pacientes com SCA, AVC Isquêmico Agudo ou AIT.
Esquecimento de dose
Lapsos durante a terapia devem ser evitados. Se você esquecer-se de tomar uma dose de Artag® deve tomar sua próxima dose no horário programado.
Interrupção prematura
A interrupção prematura de tratamentos que ajudam a impedir o acúmulo de plaquetas (antiplaquetários), incluindo Artag®, antes do tempo recomendado, poderia resultar em um aumento do risco de morte por doenças cardiovasculares ou infarto do miocárdio ou AVC (derrame) devido à doença de base do paciente.
Os médicos que desejam alterar a terapia para Artag® devem administrar a primeira dose de Artag® 24 horas após a última dose do outro medicamento antiplaquetário.
Populações Especiais
Pacientes pediátricos
A segurança e a eficácia em crianças abaixo de 18 anos de idade não foram estabelecidas.
Idosos
Não é necessário ajuste de dose.
Pacientes com insuficiência renal (alterações nos rins)
Em pacientes com doença renal terminal em diálise, os dados de estudos com ticagrelor demonstraram que o medicamento não é dialisável, ou seja, não é retirado da corrente sanguínea durante o procedimento de diálise, e mantém seu efeito clínico mesmo após a diálise. Não é necessário ajuste de dose em pacientes com insuficiência renal.
Pacientes com insuficiência hepática (alterações no fígado)
Não é necessário ajuste de dose para pacientes com insuficiência hepática leve. O ticagrelor não foi estudado em pacientes com insuficiência hepática grave, portanto, o seu uso é contraindicado. Informações limitadas estão disponíveis em pacientes com insuficiência hepática moderada, então o Artag® deve ser usado com cautela nesses casos.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Se você esquecer de tomar uma dose de ARTAG®, tome a dose seguinte no horário habitual. Não tome uma dose em dobro (duas doses ao mesmo tempo) para compensar a dose esquecida.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Antes de usar Artag® verifique com seu médico se você tem um risco aumentado de sangramento devido a:
- Um trauma recente, cirurgia recente (incluindo procedimentos odontológicos), sangramento gastrointestinal ativo ou recente, alterações moderadas no fígado ou risco aumentado de trauma. O uso de Artag® é contraindicado se você estiver com sangramento ativo ou recente causado por alguma doença e se tiver histórico de sangramento intracraniano e alterações graves no fígado.
- Administração concomitante de medicamentos que podem aumentar o risco de sangramento (por exemplo, anti-inflamatórios não esteroidais, anticoagulantes orais e/ou fibrinolíticos dentro de 24 horas da dose de Artag®).
Recomenda-se precaução em pacientes com risco aumentado de bradiarritmia (frequência cardíaca baixa), sem marcapasso, ou síncope (perda abrupta da consciência).
Uma condição chamada púrpura trombocitopênica trombótica - PTT (anemia, entupimento de pequenos vasos sanguíneos e redução da contagem de plaquetas no sangue) foi reportada muito raramente com o uso de ticagrelor. PTT é uma condição séria e requer tratamento imediato. No caso do aparecimento de sangramentos e manchas arroxeadas não associadas à trauma procure um médico imediatamente.
Recomenda-se também precaução em pacientes com asma e/ou doença pulmonar obstrutiva crônica (DPOC), uma vez que o uso de ticagrelor pode aumentar o risco absoluto de ocorrência de dispneia (falta de ar) nestes pacientes.
Caso você sinta falta de ar ou apresente sinais de respiração com ritmo irregular (como respiração acelerada, reduzida ou com pequenas pausas na respiração) durante o tratamento com Artag® avise seu médico.
Efeito sobre a capacidade de dirigir veículos e operar máquinas
Não é esperado que Artag® afete a capacidade de dirigir veículos e operar máquinas. Durante o tratamento do infarto ou da angina instável, pode ocorrer tontura e confusão. Se você tem esses sintomas, você deve ter cuidado ao dirigir veículos e operar máquinas.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Antes de tomar Artag®, fale com seu médico se você estiver grávida, tentando engravidar ou se estiver amamentando. O seu médico discutirá com você os riscos de tomar Artag® durante este período.
Atenção: este medicamento contém manitol (114 mg/comprimido), portanto, deve ser usado com cautela e a critério médico em pacientes portadores de diabetes.
Artag® contém manitol, que pode ter um leve efeito laxativo.
As seguintes reações adversas foram identificadas nos estudos com ticagrelor:
- Reação muito comum (ocorre em 10% ou mais dos pacientes que utilizam este medicamento): distúrbio hemorrágico (de sangramento), alteração (aumento) no resultado de exame laboratorial referente aos níveis de ácido úrico, dispneia (ou falta de ar – sintoma no qual a pessoa tem desconforto ou dificuldade para respirar).
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): gota, tontura, síncope (perda temporária da consciência provocada por uma diminuição do fluxo sanguíneo cerebral, dor de cabeça, vertigem, hipotensão (pressão arterial baixa), sangramento do sistema respiratório (sangramento nasal, tosse com sangue), hemorragias gastrointestinais (sangramento no estômago ou intestino), diarreia, náusea, dispepsia, constipação, sangramento na pele (dérmico ou subcutâneo), prurido (coceira no corpo), erupção cutânea (lesões avermelhadas na pele), sangramento do trato urinário, alteração (aumento) no resultado de exame laboratorial referente aos níveis de creatinina sanguínea, sangramento pós-procedimento, sangramento traumático.
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): sangramento de câncer, reações alérgicas que podem incluir angioedema (inchaço da face, lábios, boca, língua ou garganta podendo causar dificuldade de engolir ou respirar), confusão, hemorragia intracraniana (sangramento no interior do cérebro), hemorragia ocular (sangramento nos olhos), hemorragia auricular (sangramento no ouvido), hemorragia retroperitoneal (sangramento no abdômen), hemorragia muscular (sangramento nos músculos e nas “juntas”), sangramento do sistema reprodutivo (sangramento pela vagina ou pênis).
As seguintes reações adversas foram identificadas no uso pós-comercialização de ticagrelor:
Uma vez que estas reações são reportadas voluntariamente por uma população de tamanho desconhecido, não é sempre possível estimar com exatidão suas frequências.
- Distúrbios do sistema nervoso: apneia central do sono, incluindo respiração com ritmo irregular, acelerado ou com pausas;
- Distúrbios no sangue: púrpura trombocitopênica trombótica (uma doença que pode apresentar sintomas como: febre e manchas arroxeadas [chamadas púrpura] na pele ou na boca, com ou sem amarelamento da pele ou olhos [icterícia], e confusão ou cansaço extremo inexplicado);
- Distúrbios do coração: bradiarritmia (frequência cardíaca baixa), bloqueios atrioventriculares (atrasos na condução elétrica do coração).
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também à empresa através do seu serviço de atendimento.
Medicamento similar equivalente ao medicamento de referência.
Comprimidos revestidos 90 mg
Embalagens com 20 ou 60 comprimidos.
Uso oral.
Uso adulto.
Cada comprimido revestido contém:
90 mg de ticagrelor.
Excipientes: copolímero de álcool polivinílico e macrogol, fosfato de cálcio dibásico di-hidratado, manitol, dióxido de silício, croscarmelose sódica, estearato de magnésio, hipromelose, macrogol, dióxido de titânio, amarelo de quinolina laca de alumínio e azul brilhante 133 laca de alumínio.
Tratamento
Em caso de ingestão de uma quantidade maior do medicamento que a prescrita pelo seu médico, você deve imediatamente entrar em contato com o seu médico e/ou ir a um hospital, levando a embalagem do medicamento com você.
Sintomas
Pode ocorrer um risco aumentado de sangramento, falta de ar e anormalidade dos batimentos cardíacos.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Artag® deve ser utilizado com cuidado se você estiver tomando os seguintes medicamentos:
- Diltiazem, amprenavir, aprepitanto, eritromicina, fluconazol, verapamil, rifampicina, fenitoína, carbamazepina, fenobarbital, ciclosporina, sinvastatina, lovastatina, atorvastatina, digoxina, morfina.
Você não deve iniciar o tratamento com Artag® se estiver tomando os seguintes medicamentos:
- Cetoconazol, claritromicina, nefazodona, ritonavir, atazanavir.
O uso concomitante de Artag® e altas doses de ácido acetilsalicílico (AAS) (>300 mg) não é recomendado.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Resultados de Eficácia
A eficácia de Ticagrelor é procedente do estudo PLATO (PLATelet Inhibition and Patient Outcomes), um estudo comparativo de Ticagrelor e clopidogrel, ambos administrados em combinação com ácido acetilsalicílico e outras terapias padrão.
O estudo PLATO foi um estudo randomizado, duplo-cego, de grupos paralelos, fase III, com 18.624 pacientes, que avaliou eficácia e segurança de Ticagrelor comparado com clopidogrel para prevenção de eventos vasculares em pacientes com Síndrome Coronariana Aguda (angina instável, infarto agudo do miocárdio sem elevação do segmento ST [IAMSST] ou infarto agudo do miocárdio com elevação do segmento ST [IAMCST]).
O estudo foi composto de pacientes que se apresentaram no prazo de 24 horas do início do episódio mais recente da dor no peito ou sintomas relacionados. Os pacientes foram randomizados para receber clopidogrel (75 mg uma vez ao dia, com uma dose de ataque inicial de 300 mg se a terapia com tienopiridina não houvesse sido administrada anteriormente.
Uma dose de ataque adicional de 300 mg foi permitida, a critério do investigador), ou uma dose de ataque de 180 mg de Ticagrelor seguido por uma dose de manutenção de 90 mg de Ticagrelor duas vezes ao dia. Os pacientes poderiam ser controlados clinicamente, tratados com intervenção coronária percutânea (ICP) ou cirurgia de revascularização do miocárdio (RM).
Figura. Mostra a estimativa do risco para a primeira ocorrência de qualquer evento no desfecho composto de eficácia

Ticagrelor reduziu a ocorrência do desfecho composto primário comparado ao clopidogrel em ambas as populações AI/ IAMCST e IAMSST.
Tabela. Eventos de desfecho no estudo PLATO
| Desfecho primário | Pacientes com eventos | ||||
|
Ticagrelor |
Clopidogrel (%) N=9291 |
Redução do Risco Relativo (a) (%) | Hazard Ratio (HR) (IC 95%) | valor-p | |
| Composto de morte CV/IM (excluindo IM silencioso)/AVC | 9,3 | 10,9 | 16 | 0,84 (0,77;0,92) |
p=0,0003 |
| Morte CV | 3,8 | 4,8 | 21 | 0,79 (0,69;0,91) |
p=0,0013 |
| IM (excluindo IM silencioso) (a) | 5,4 | 6,4 | 16 | 0,84 (0,75;0,95) |
p=0,0045 |
| AVC | 1,3 | 1,1 | -17 | 1,17 (0,91;1,52) |
p=0,2249 |
|
Desfechos secundários |
|||||
| Composto de morte CV/IM (excluindo IM silencioso) /AVC – intenção de tratar invasivamente(a) | 8,5 | 10,0 | 16 | 0,84 (0,75;0,94) |
p=0,0025 |
| Composto de mortalidade por todas as causas /IM (excluindo IM silencioso)/AVC | 9,7 | 11,5 | 16 | 0,84 (0,77;0,92) |
p=0,0001 |
| Composto de morte CV/IM total/AVC/IRS /IR/AIT/outros EAT(b) | 13,8 | 15,7 | 12 | 0,88 (0,81;0,95) |
p=0,0006 |
| Mortalidade por todas as causas | 4,3 | 5,4 | 22 | (0,69;0,89) 0,78 | p=0,0003** |
(a) RRR= (1-HR) x 100%. Valores com uma redução do risco relativo negativo indicam um aumento do risco relativo.
(b) IRS = isquemia recorrente severa / IR = isquemia recorrente / AIT= acidente isquêmico transitório / EAT= evento arterial trombótico.
** valor-p nominal.
Ticagrelor é superior ao clopidogrel na prevenção de eventos trombóticos (RRR 16%; RRA 1,9%; NNT =54) no desfecho composto de eficácia (morte CV, IM e AVC) em 12 meses. A diferença nos tratamentos foi determinada pela morte cardiovascular e infarto do miocárdio sem diferença nos acidentes vasculares cerebrais.
Ticagrelor demonstrou uma redução do risco relativo estatisticamente significativo de 16% (RRA 1,1%) para IM e uma redução do risco relativo de 21% (RRA 1,1%) para morte CV. Tratar 91 pacientes com Ticagrelor ao invés de clopidogrel prevenirá 1 morte CV.
Ticagrelor demonstrou superioridade em relação ao clopidogrel na prevenção do desfecho composto (morte CV, IM ou AVC). Os resultados foram precoces (redução de risco absoluto [RRA] de 0,6% e Redução do Risco Relativo [RRR] de 12% em 30 dias), com efeitos observados no tratamento mantidos durante o período de 12 meses, resultando em uma RRA de 1,9% ao ano com RRR de 16%. Isto sugere que o tratamento é apropriado por pelo menos 12 meses.
No estudo PLATO um grande número de comparações de subgrupos foram conduzidas do desfecho de eficácia primário para avaliar a robustez e consistência do benefício global. O efeito do tratamento de Ticagrelor em comparação ao clopidogrel parece consistente entre os múltiplos subgrupos de pacientes pelas características demográficas, incluindo peso, sexo, antecedentes clínicos, terapia concomitante e pelo diagnóstico final do evento (IAMSST, IAMCST e AI).
Uma fraca, mas significativa interação do tratamento foi observada por região em que o HR para o desfecho primário favorece Ticagrelor no resto do mundo, mas favorece o clopidogrel na América do Norte, que representou aproximadamente 10% do total da população estudada (valor-p da interação = 0,045).
Essa aparente interação de tratamento por região observada no PLATO pode plausivelmente ser atribuída ao acaso, pelo menos em parte. Análises adicionais sugerem que a eficácia de Ticagrelor em relação ao clopidogrel está associada à dose de ácido acetilsalicílico durante a terapia de manutenção. Os dados mostram uma maior eficácia de Ticagrelor em relação ao clopidogrel, quando utilizados em associação com uma dose baixa de ácido acetilsalicílico (75-150 mg).
A eficácia relativa de Ticagrelor versus clopidogrel, quando utilizado com altas doses de ácido acetilsalicílico (> 300 mg) é menos evidente. Baseado nessas observações da relação entre a dose de manutenção do ácido acetilsalicílico e a eficácia relativa de Ticagrelor em comparação ao clopidogrel, é recomendado que Ticagrelor seja utilizado com uma dose baixa de ácido acetilsalicílico de 75-150 mg.
Os benefícios associados com Ticagrelor também foram independentes do uso de outras terapias cardiovasculares indicadas na fase aguda e de longo-prazo, incluindo heparina, heparina de baixo peso molecular (HBPM), inibidores GpIIb/IIIa por via intravenosa, medicamentos hipolipemiantes, betabloqueadores, inibidores da enzima conversora da angiotensina (ECA), antagonistas dos receptores da angiotensina II e inibidores da bomba de prótons.
Ticagrelor demonstrou uma redução do risco relativo (RRR) estatisticamente significativa no desfecho composto de morte cardiovascular (CV), infarto do miocárdio (IM) e acidente vascular cerebral (AVC) em pacientes com SCA com intenção de tratamento invasivo (RRR 16%; RRA 1,7%; p = 0,0025). Em uma análise exploratória, Ticagrelor demonstrou uma redução do risco relativo do desfecho composto primário em pacientes com SCA com intenção de tratamento clínico (RRR 15%; RRA 2,3%; p nominal = 0,0444).
Consistente com o desfecho primário do estudo, o efeito nesses dois grupos foi determinado pela morte CV e IM, sem efeito em AVC. Em pacientes recebendo stents houve numericamente menos trombose definitiva de stent entre pacientes tratados com Ticagrelor comparado com o clopidogrel (73 versus 107; RRR 32%; RRA 0,6%; p nominal = 0,0123).
Ticagrelor demonstrou uma RRR estatisticamente significativa de 16% (RRA 2,1%) para o composto de mortalidade por todas as causas, IM e AVC comparado com o clopidogrel.
O desfecho secundário final (mortalidade por todas as causas) foi avaliado. Ticagrelor demonstrou uma RRR de 22% de mortalidade por todas as causas comparado com o clopidogrel com um nível de significância de p = 0,0003 e uma RRA de 1,4%.
Subestudo de Holter
Para estudar a ocorrência de pausas ventriculares e outros episódios arrítmicos durante o estudo PLATO, investigadores realizaram monitoramento de Holter em um subconjunto de cerca de 3.000 pacientes, dos quais aproximadamente 2.000 tinham gravações tanto na fase aguda da SCA quanto um mês depois. A principal variável de interesse foi a ocorrência de pausas ventriculares ≥ 3 segundos. Mais pacientes tiveram pausas ventriculares com Ticagrelor (6,0%) do que com o clopidogrel (3,5%) na fase aguda; e 2,2% e 1,6%, respectivamente, um mês depois. Mais pacientes tiveram pausas ventriculares com Ticagrelor que com clopidogrel, entretanto, não houve consequências clínicas adversas associadas a esta diferença (incluindo inserções de marcapasso) nesta população de pacientes.
O Ticagrelor é ativo oralmente. Diferente do clopidogrel, ele não requer a atividade enzimática da CYP450 para inibir a agregação plaquetária. Polimorfismos no gene codificador para a enzima 2C19 da CYP450 podem impactar a eficácia de clopidogrel. Polimorfismo no gene codificador para o transportador (ABCB1) da glicoproteína-P pode impactar na eficácia de ambos, clopidogrel e Ticagrelor.
No estudo PLATO, amostras genéticas de 10.285 pacientes foram analisadas para determinação do genótipo do CYP2C19 e loco ABCB1. Foram analisadas associações de grupos de genótipo em relação aos resultados de eficácia e segurança do estudo PLATO.
- A superioridade de Ticagrelor em relação ao clopidogrel não é significativamente afetada em pacientes genótipo CYP2C19.
- Ticagrelor reduz eventos CV maiores comparado ao clopidogrel independentemente do genótipo CYP2C19.
- As taxas de eventos para Ticagrelor não variaram com o genótipo CYP2C19.
- No grupo tratado com clopidogrel, portadores do alelo da CYP2C19 de perda da função tiveram um aumento das taxas de eventos de desfecho primário em comparação aos não-portadores.
- Assim como no estudo PLATO, o sangramento maior total não diferiu entre Ticagrelor e clopidogrel independentemente do genótipo CYP2C19, embora os pacientes com um ou mais alelos de ganho de função (GOF) tenham tido taxas mais altas de sangramento maior com clopidogrel.
- Assim como no estudo PLATO global, o sangramento não relacionado a procedimento cirúrgico de RM aorta-coronariana aumentou com Ticagrelor em relação ao clopidogrel em paciente com alelo da CYP2C19 de perda de função.
- Sangramento não relacionado a procedimento cirúrgico de RM aorta-coronariana foi similar entre Ticagrelor e clopidogrel em pacientes sem o alelo de perda de função.
Desfechos de eficácia e segurança combinados
Desfechos de eficácia e segurança combinados (morte CV, IM, AVC, ou sangramento “maior total” segundo a definição do PLATO) sustentam o benefício clínico do Ticagrelor comparado com o clopidogrel (RRR 8%; RRA 1,4%; HR 0,92; p = 0,0257) por mais de 12 meses após os eventos de SCA.
Características Farmacológicas
Propriedades Farmacodinâmicas
Mecanismo de ação
Ticagrelor contém Ticagrelor um membro da classe química ciclopentiltriazolopirimidinas (CPTP), que é antagonista seletivo oral, de ação direta e de ligação reversível ao receptor P2Y12 que previne a ativação e agregação plaquetária mediada por adenosina difosfato (ADP) P2Y12 dependente.
O Ticagrelor não previne a ligação do ADP, mas quando ligado ao receptor P2Y12 previne a transdução de sinal ADP induzida. Como as plaquetas participam na iniciação e/ou evolução de complicações trombóticas da doença arterosclerótica, a inibição da função plaquetária tem demonstrado redução do risco de eventos cardiovasculares como morte, infarto do miocárdio ou acidente vascular cerebral.
O Ticagrelor possui um mecanismo de ação adicional, aumentando os níveis de adenosina endógena pela inibição do transportador equilibrativo 1 de nucleosídeo (ENT-1). A adenosina é formada localmente nos pontos de hipóxia e dano tecidual, através da degradação da adenosina tri- e di-fosfato (ATP e ADP) liberada.
Como a degradação da adenosina é essencialmente restrita ao espaço intracelular, a inibição do ENT-1 pelo Ticagrelor prolonga a meia-vida da adenosina e, portanto, aumenta a sua concentração extracelular local promovendo aumento localizado das respostas à adenosina. O Ticagrelor não possui efeito significativo direto nos receptores de adenosina (A1, A2A, A2B, A3) e não é metabolizado à adenosina.
Tem sido documentado que a adenosina possui um número de efeitos que incluem: vasodilatação, cardioproteção, inibição da agregação plaquetária, modulação da inflamação e indução de dispneia, o que pode contribuir para o perfil clínico do Ticagrelor.
Efeitos farmacodinâmicos
Início da Ação
Extensão média final de Inibição (± EP*) da Agregação Plaquetária (IAP) após doses orais únicas de 180 mg de Ticagrelor ou 600 mg de clopidogrel em pacientes com Doença Arterial Coronariana (DAC) estável.

*EP: erro padrão.
Em pacientes com DAC estável em terapia com o ácido acetilsalicílico, Ticagrelor demonstra um rápido início de efeito farmacológico, como demonstrado pela média de IAP para Ticagrelor em 0,5 horas após dose de ataque de 180 mg em torno de 41%, com o efeito IAP máximo de 87,9% a 89,6% por 2-4 horas pós-dose. 90% dos pacientes tiveram um alcance final de IAP >70% por 2 horas pós-dose. O alto efeito da IAP de Ticagrelor entre 87% -89% foi mantido entre 2-8 horas.
Extensão média final de Inibição (± EP) da Agregação Plaquetária (IAP) após a última dose de manutenção de 90 mg duas vezes ao dia de Ticagrelor ou 75 mg de clopidogrel uma vez ao dia ou placebo.
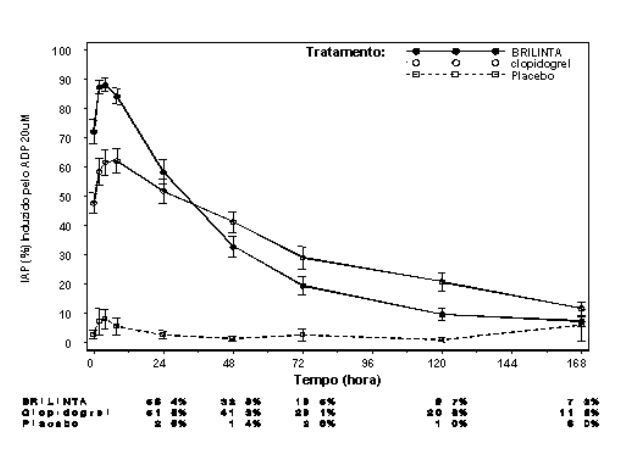
Reversão de Efeito
Após o declínio das concentrações de Ticagrelor e de seu metabólito ativo a um nível inferior ao requerido para saturação do receptor, a IAP diminui gradualmente com o declínio das concentrações plasmáticas. Uma vez que Ticagrelor se liga reversivelmente, a recuperação da função plaquetária não depende da reposição de plaquetas. Ticagrelor tem uma taxa de reversão mais rápida da IAP em comparação com o clopidogrel, conforme determinado pela inclinação de reversão de 4-72 horas após a última dose.
A extensão média final da IAP medida após a última dose de Ticagrelor é aproximadamente 20-30% maior para Ticagrelor comparado com o clopidogrel. Entretanto, por 24 horas pós-dose, a % da IAP é similar entre Ticagrelor e clopidogrel, e é menor para Ticagrelor a partir de 72 horas em até 7 dias comparado com o clopidogrel. A % média da IAP para Ticagrelor em 72 horas (Dia 3) após última dose foi comparável ao clopidogrel no Dia 5, e a % da IAP para Ticagrelor no Dia 5 foi similar ao clopidogrel no Dia 7, que não é estatisticamente diferente do placebo.
Respondedores ao Ticagrelor
A IAP induzida por Ticagrelor tem menor variabilidade nos picos de concentrações plasmáticas de Ticagrelor e seu metabólito ativo observados com a dose de 90 mg duas vezes ao dia em comparação ao clopidogrel.
Pacientes com doença arterial coronariana estável, predeterminados a terem menor resposta IAP ao clopidogrel (não-respondedores), e que receberam uma dose concomitante de ácido acetilsalicílico, exibiram maior média de resposta IAP após administração de Ticagrelor comparado ao clopidogrel. Em não-respondedores ao clopidogrel, a resposta observada de IAP ao Ticagrelor foi maior e mais consistente.
O tratamento de Ticagrelor resultou em IAP consistentemente mais elevada em comparação com o clopidogrel, e isso foi aparente após a dose para ambos os respondedores e não-respondedores.
Dados de troca
A troca de clopidogrel para Ticagrelor resulta em um aumento absoluto da IAP de 26,4% e a troca de Ticagrelor para clopidogrel resulta em uma diminuição absoluta da IAP de 24,5%. Os pacientes podem ser transferidos de clopidogrel para Ticagrelor sem a interrupção do efeito antiplaquetário.
Mecanismo da Adenosina (ENT-1)
O Ticagrelor aumenta a concentração plasmática de adenosina em pacientes SCA e tem demonstrado que amplia inúmeras respostas fisiológicas à adenosina. A adenosina é um vasodilatador; Ticagrelor demonstrou que amplia o aumento do fluxo sanguíneo coronário induzido por adenosina em voluntários saudáveis e em pacientes SCA. Adenosina é um inibidor plaquetário endógeno; Ticagrelor demonstrou que aumenta a inibição da agregação plaquetária mediada por adenosina em adição à inibição plaquetária decorrente do seu antagonismo ao P2Y12.
A adenosina está associada ao efeito cardioprotetor de pré-condicionamento; em um modelo em ratos com lesão de reperfusão, Ticagrelor demonstrou redução do tamanho do infarto através do mecanismo mediado por adenosina. A adenosina também induz dispneia; Ticagrelor demonstrou ampliação da dispneia adenosina-induzida em voluntários saudáveis. Desta maneira, a dispneia observada em alguns pacientes que utilizam Ticagrelor pode ser parcialmente ou completamente mediada por adenosina.
Propriedades Farmacocinéticas
Geral
O Ticagrelor demonstra farmacocinética linear, e a exposição ao Ticagrelor e ao metabólito ativo (ARC124910XX) são aproximadamente proporcionais à dose.
Absorção
A absorção de Ticagrelor é rápida, com uma tmax mediana de aproximadamente 1,5 horas. A formação do principal metabólito circulante AR-C124910XX (também ativo) de Ticagrelor é rápida, com uma Tmax mediana de aproximadamente 2,5 horas. A Cmáx e a AUC de Ticagrelor e do metabólito ativo aumentaram de uma maneira aproximadamente proporcional à dose por toda faixa de doses estudadas (30 - 1260 mg).
A biodisponibilidade média absoluta de Ticagrelor foi estimada em 36% (faixa de 25,4% a 64,0%). A ingestão de uma refeição rica em gordura não teve efeito sobre a Cmáx de Ticagrelor ou a AUC do metabólito ativo, mas resultou em um aumento de 21% na AUC de Ticagrelor e uma diminuição de 22% na Cmáx do metabólito ativo. Estas pequenas alterações são consideradas de mínima relevância clínica, portanto, Ticagrelor pode ser administrado com ou sem alimentos.
Distribuição
O volume de distribuição de Ticagrelor no estado de equilíbrio é 87,5 L. Ticagrelor e o metabólito ativo são extensivamente ligados às proteínas plasmáticas humanas (> 99,0%).
Metabolismo
A CYP3A é a principal enzima responsável pelo metabolismo de Ticagrelor e a formação do metabólito ativo e suas interações com outros substratos da CYP3A variam da ativação até a inibição. Ticagrelor e o metabólito ativo são fracos inibidores da glicoproteína-P.
O principal metabólito de Ticagrelor é o AR-C124910XX, que também é ativo como avaliado in vitro pela ligação ao receptor de ADP P2Y12 das plaquetas. A exposição sistêmica ao metabólito ativo é aproximadamente 30-40% do obtido por Ticagrelor.
Excreção
A principal via de eliminação de Ticagrelor é por metabolização hepática. Quando Ticagrelor marcado radioativamente é administrado, a recuperação média da radioatividade é de aproximadamente 84% (57,8% nas fezes, 26,5% na urina). Recuperações de Ticagrelor e do metabólito ativo na urina foram menor que 1% da dose. A primeira via de eliminação do metabólito ativo é principalmente através da secreção biliar. A t1/2 média foi aproximadamente 6,9 horas (faixa 4,5-12,8 horas) para Ticagrelor e 8,6 horas (faixa 6,5-12,8 horas) para o metabólito ativo.
Populações especiais
Idosos
Exposições maiores ao Ticagrelor (aproximadamente 60% para Cmáx e para AUC) e ao metabólito ativo (aproximadamente 50% para Cmáx e para AUC) foram observadas em indivíduos idosos (≥ 65 anos) em comparação com indivíduos mais jovens. Estas diferenças não são consideradas clinicamente significativas.
Pediátrico
Ticagrelor não foi avaliado em uma população pediátrica.
Sexo
Exposições maiores ao Ticagrelor (aproximadamente 52% e 37% para Cmáx e AUC, respectivamente) e ao metabólito ativo (aproximadamente 50% para Cmáx e para AUC) foram observadas em mulheres em relação aos homens. Estas diferenças não são consideradas clinicamente significativas.
Insuficiência renal
A exposição ao Ticagrelor foi aproximadamente 20% menor e a exposição ao metabólito ativo foi aproximadamente 17% maior em pacientes com insuficiência renal grave comparado a indivíduos com função renal normal. O efeito de IAP de Ticagrelor foi similar entre os dois grupos, entretanto, houve maior variabilidade observada na resposta individual em pacientes com insuficiência renal grave. Não é necessário ajuste de dose em pacientes com insuficiência renal. Não há informações disponíveis referente ao tratamento de pacientes em diálise renal.
Insuficiência hepática
A Cmáx e a AUC para Ticagrelor foram 12% e 23% maiores em pacientes com insuficiência hepática leve em comparação com indivíduos saudáveis, respectivamente, entretanto, o efeito de IAP de Ticagrelor foi similar entre os dois grupos. Não é necessário ajuste de dose em pacientes com insuficiência hepática leve. Ticagrelor não foi estudado em pacientes com insuficiência hepática moderada ou grave.
Raça
Pacientes de origem asiática têm uma biodisponibilidade média 39% mais alta em comparação com pacientes caucasianos. Pacientes autoidentificados como negros tiveram uma biodisponibilidade 18% menor de Ticagrelor comparados a pacientes caucasianos. Em estudos de farmacologia clínica, a exposição (Cmáx e AUC) de Ticagrelor em indivíduos japoneses foi aproximadamente 40% (20% após o ajuste para o peso corporal) maior comparada com a de caucasianos.
Dados de segurança pré-clínica
Dados pré-clínicos para o Ticagrelor e o principal metabólito não demonstraram risco inaceitável para efeitos adversos para humanos baseado em estudos convencionais de farmacologia de segurança, toxicidade de dose única e repetida e potencial genotóxico.
Reações adversas não observadas em estudos clínicos, mas observadas em animais com níveis de exposição similar ou superior aos níveis de exposição clínica e com possível relevância para o uso clínico foram: GI (gastrointestinais) e irritação gastrointestinal.
Não foram observados tumores relacionados ao composto em um estudo de 2 anos com camundongos em doses orais até 250 mg/kg/dia (> 18 vezes a exposição terapêutica humana). Não houve aumento nos tumores em ratos machos em doses orais até 120 mg/kg/dia (> 15 vezes a exposição terapêutica humana). Houve um aumento de adenocarcinomas uterinos e adenomas hepatocelulares mais adenocarcinomas e uma redução nos adenomas hipofisários e fibroadenomas mamários em ratas expostas somente a altas doses (> 25 vezes a exposição terapêutica humana).
Não foi observada alteração na incidência de tumores em doses de 60 mg/kg/dia (diferença > 8 vezes para a dose terapêutica humana.). Os tumores uterinos observados apenas em ratos foram achados ser o resultado de um efeito endócrino não-genotóxico do desequilíbrio hormonal presente em ratos que receberam altas doses de Ticagrelor.
Os tumores benignos do fígado são considerados secundários a resposta pelo fígado para a carga metabólica localizada no fígado a partir de doses elevadas de Ticagrelor.
O Ticagrelor foi testado em uma faixa de testes in vitro e in vivo e não foi mostrado ser genotóxico.
O Ticagrelor não demonstrou ter efeito na fertilidade de ratas fêmeas em doses orais até 200 mg/kg por dia (aproximadamente 20 vezes a exposição terapêutica humana) e não teve efeito sobre a fertilidade de ratos machos em doses até 180 mg/kg/dia (15,7 vezes a exposição terapêutica humana).
O Ticagrelor não teve efeito no desenvolvimento fetal em doses orais até 100 mg/kg por dia em ratos (5,1 vezes a exposição terapêutica humana) e até 42 mg/kg/dia em coelhos (equivalente à exposição terapêutica humana). O Ticagrelor não teve efeitos no parto ou no desenvolvimento pós-natal em ratos com doses até 60 mg/kg/dia (4,6 vezes a exposição terapêutica humana).
Você deve conservar Artag® em temperatura ambiente (15ºC a 30ºC).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Caracteristcas do medicamento
Os comprimidos de Artag® são apresentados da seguinte maneira: comprimido revestido verde claro, circular, biconvexo e liso.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
MS nº: 1.0033.0221
Farm. Resp.:
Cintia Delphino de Andrade
CRF-SP nº 25.125
Registrado por:
Libbs Farmacêutica Ltda.
Av. Marques de São Vicente, 2.219, 2º andar – São Paulo – SP
CNPJ: 61.230.314/0001-75
Fabricado por:
Libbs Farmacêutica Ltda.
Rua Alberto Correia Francfort, 88 – Embu das Artes – SP
Indústria Brasileira.
Venda sob prescrição médica.
Especificações sobre o Artag
Caracteristicas Principais
Fabricante:
Necessita de Receita:
Branca Comum (Venda Sob Prescrição Médica)
Principio Ativo:
Categoria do Medicamento:
Classe Terapêutica:
Especialidades:
Cirurgia vascular
Cardiologia
Angiologia
Doenças Relacionadas:
Bula do Paciente:
Bula do Profissional:
ARTAG É UM MEDICAMENTO. SEU USO PODE TRAZER RISCOS. PROCURE UM MÉDICO OU UM FARMACÊUTICO. LEIA A BULA. MEDICAMENTOS PODEM CAUSAR EFEITOS INDESEJADOS. EVITE A AUTOMEDICAÇÃO: INFORME-SE COM SEU MÉDICO OU FARMACÊUTICO.
Sobre a Libbs Farmacêutica
A Libbs é uma empresa do ramo farmacêutico, que tem como objetivo proporcionar às pessoas uma vida mais plena e saudável. É 100% brasileira e possui mais de meio século de história, desde seu início se destacando no cenário nacional.
São fornecedores de um amplo portfólio de medicamentos das mais várias especialidades, buscando entender os pacientes em suas individualidades.
Assim, proporcionam medicamentos eficazes e confiáveis, que além de tudo inovam em suas formulações e apresentações. Seus produtos são pensados para proporcionar conforto, bem-estar e facilidade de uso.
Fonte: https://www.libbs.com.br
Ofertas Recomendadas
À partir de
R$
14,50
Descubra a Melhor Opção de Artag para Você
Compare e escolha entre variações com facilidade
| Artag 90mg, caixa com 20 comprimidos revestidos | Artag 90mg, caixa com 60 comprimidos revestidos | |
Dose | 90mg | 90mg |
Forma Farmacêutica | Comprimido revestido | Comprimido revestido |
Quantidade na embalagem | 20 Unidades | 60 Unidades |
Modo de uso | Uso oral | Uso oral |
Substância ativa | Ticagrelor | Ticagrelor |
Preço Máximo ao Consumidor/SP | R$ 165,44 | R$ 496,30 |
Preço de Fábrica/SP | R$ 119,67 | R$ 359,00 |
Tipo do Medicamento | Similar Intercambiável | Similar Intercambiável |
Pode partir? | Este medicamento não pode ser partido | Este medicamento não pode ser partido |
Registro Anvisa | 1003302210016 | 1003302210024 |
Precisa de receita | Sim, precisa de receita | Sim, precisa de receita |
Tipo da Receita | Branca Comum (Venda Sob Prescrição Médica) | Branca Comum (Venda Sob Prescrição Médica) |
Código de Barras | 7896094210974 | 7896094210967 |


