Voriconazol
(49)Preço
Tipo de receita
- Branca Comum (Venda Sob Prescrição Médica)
Classe terapêutica
- Agentes Sistêmicos para Infecções Fúngicas
Forma farmacêutica
- Comprimido revestido
- Pó para solução injetável
- Solução injetável
Categoria
- Medicamentos
- Aspergilose
- Candidíase
- Medicamentos Alto Custo
- Infecções
- Produtos Hospitalares
- Antifúngico
Dosagem
- 200mg
- 50mg
Fabricante
- Laboratório Cristália
- Accord Farma
- Camber
- Wyeth/Pfizer
- Bergamo/Amgen
- Farma Vision Importadora e Exportadora de Medicamentos
- Pfizer
- Doctor Reddy's
- Glenmark
- Neo Química
Princípio ativo
- Voriconazol
Tipo do medicamento
- Genérico
- Similar
- Similar Intercambiável
- Novo
Quantidade
- 0
- 14 Unidades
- 10 Unidades
- 2 Unidades
- 30 Unidades
- 100 Unidades
- 5 Unidades
- 7 Unidades
- 20 Unidades
Bula do Voriconazol
Voriconazol, para o que é indicado e para o que serve?
Voriconazol é um agente antifúngico triazólico de amplo espectro, e é indicado para tratamento de aspergilose invasiva; tratamento de infecções invasivas graves por Candida, incluindo candidemia e candidíase esofágica (incluindo C. krusei) e; tratamento de infecções fúngicas graves causadas por Scedosporium spp. e Fusarium spp.
Voriconazol deve ser administrado principalmente a pacientes com infecções progressivas e passíveis de causar a morte.
Quais as contraindicações do Voriconazol?
Voriconazol é contraindicado a pacientes com hipersensibilidade conhecida ao voriconazol ou a qualquer componente da fórmula.
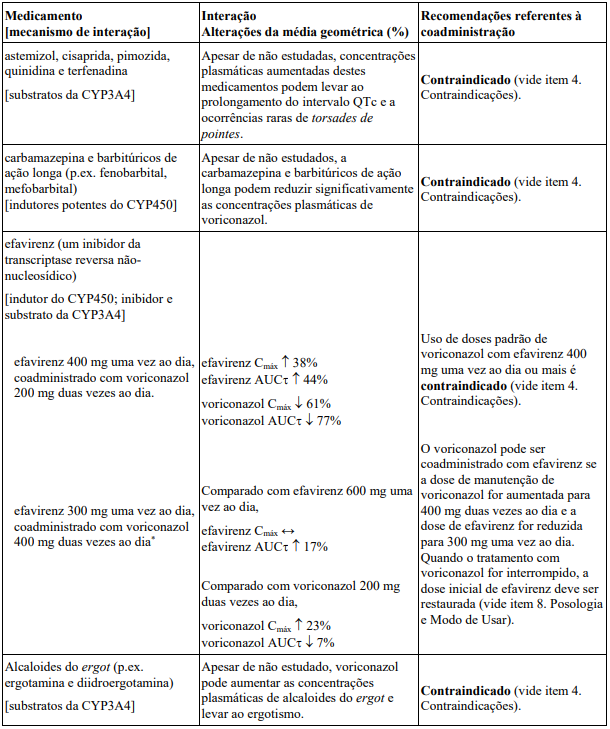
A coadministração de substratos do CYP3A4, tais como terfenadina, astemizol, cisaprida, pimozida ou quinidina com Voriconazol é contraindicada, uma vez que o aumento da concentração plasmática desses fármacos pode levar ao prolongamento do intervalo QTc e ocorrências raras de torsade de pointes.
A coadministração de Voriconazol e sirolimo está contraindicada uma vez que voriconazol pode causar aumento significativo das concentrações plasmáticas de sirolimo em indivíduos sadios.
A coadministração de Voriconazol com rifabutina, rifampicina, carbamazepina e barbitúricos de longa ação (ex.: fenobarbital) é contraindicada, uma vez que estes fármacos podem provocar decréscimo significativo das concentrações plasmáticas de voriconazol.
A coadministração de doses padrão de Voriconazol com doses de efavirenz de 400 mg uma vez ao dia ou superior é contraindicada, porque o efavirenz reduz significativamente a concentração plasmática de voriconazol em indivíduos saudáveis nestas doses. O voriconazol também aumenta significativamente a concentração plasmática de efavirenz.
A coadministração de Voriconazol e altas doses de ritonavir (400 mg e mais que duas vezes ao dia) está contraindicada uma vez que o ritonavir diminui significativamente a concentração plasmática de voriconazol nesta dose em indivíduos sadios.
A coadministração de alcaloides do ergot (ergotamina, diidroergotamina), os quais são substratos de CYP3A4, é contraindicada, uma vez que o aumento das concentrações plasmáticas desses fármacos pode levar ao ergotismo.
A coadministração de Voriconazol com Erva de São João é contraindicada.
Este medicamento é contraindicado para menores de 2 anos.
Tipo de receita
Como usar o Voriconazol?
Comprimido
Voriconazol comprimidos revestidos deve ser administrado pelo menos uma hora antes ou uma hora após a refeição.
Uso em Adultos
A terapia com Voriconazol deve ser iniciada com o regime de dose de ataque intravenoso, para se obter no Dia 1, concentrações plasmáticas adequadas. O tratamento intravenoso deve continuar por pelo menos 7 dias antes da troca para a terapia oral. Uma vez que o paciente está clinicamente melhor e torna-se tolerante a medicação administrada por via oral, o comprimido de voriconazol pode ser utilizado. Devido à alta biodisponibilidade oral (96%), a troca entre a administração intravenosa e a oral é adequada, quando indicada clinicamente.
Informações detalhadas das recomendações de dosagem são apresentadas na tabela a seguir:
|
Dose de Manutençãoa |
||
|
Pacientes com 40 kg ou mais |
Pacientes com menos de 40 kg |
|
|
Aspergilose invasivab |
200 mg a cada 12 horas |
100 mg a cada 12 horas |
|
Infecções invasivas graves por Candida, inclusive candidemia |
200 mg a cada 12 horas |
100 mg a cada 12 horas |
|
Candidíase esofágica |
200 mg a cada 12 horas |
100 mg a cada 12 horas |
|
Scedosporioses e Fusarioses |
200 mg a cada 12 horas |
100 mg a cada 12 horas |
a. Em estudos com voluntários sadios, a dose oral de 200 mg a cada 12 horas resultou em uma exposição (AUCτ) similar à dose IV de 3 mg/kg a cada 12 horas, a dose oral de 300 mg a cada 12 horas resultou em uma exposição (AUCτ) similar à dose IV de 4 mg/kg a cada 12 horas.
b. A duração mediana da terapia oral de voriconazol foi de 76 dias (variação 2 – 232 dias).
Ajuste de Dose
Caso a resposta do paciente seja inadequada, a dose de manutenção deve ser aumentada de 200 mg a cada 12 horas (similar à dose IV de 3 mg/kg a cada 12 horas) para 300 mg a cada 12 horas (similar à dose IV de 4 mg/kg a cada 12 horas), para administração oral. Para os pacientes pesando menos de 40 kg, a dose oral de manutenção pode ser aumentada de 100 mg para 150 mg a cada 12 horas.
Se os pacientes não tolerarem o tratamento com altas doses (ex. 300 mg via oral a cada 12 horas), reduzir a dose oral de manutenção para intervalos de 50 mg até a dose mínima de 200 mg a cada 12 horas (ou 100 mg a cada 12 horas para pacientes adultos com peso inferior a 40 kg).
A fenitoína pode ser coadministrada com Voriconazol se a dose de manutenção oral for aumentada de 200 mg para 400 mg, a cada 12 horas por via oral (de 100 mg para 200 mg, a cada 12 horas, em pacientes com menos de 40 kg).
Quando Voriconazol é coadministrado com doses ajustadas de efavirenz, a dose de manutenção de Voriconazol deve ser aumentada para 400 mg a cada 12 horas.
A duração do tratamento depende da resposta clínica e micológica dos pacientes.
Uso em Pacientes Idosos
Não é necessário ajuste de dose em pacientes idosos.
Uso em Pacientes com Insuficiência Renal
A farmacocinética do voriconazol administrado por via oral não é afetada pela insuficiência renal. Portanto, não é necessário ajustar a dose oral em pacientes com insuficiência renal de grau leve a grave.
O voriconazol é hemodialisável com um clearance de 121 mL/min. Uma sessão de hemodiálise com a duração de 4 horas não remove uma quantidade de voriconazol suficiente que justifique um ajuste posológico.
Uso em Pacientes com Insuficiência Hepática
Não é necessário ajuste de dose em pacientes com comprometimento hepático agudo, manifestado por elevação da função hepática detectada por testes (TGP/ALT, TGO/AST). Recomenda-se a monitoração contínua dos testes da função hepática para verificar elevações posteriores.
Para pacientes com cirrose hepática de grau leve a moderado (classe A e B de Child-Pugh), em tratamento com Voriconazol, recomenda-se o uso dos regimes de dose de ataque padrão, mas somente metade da dose de manutenção.
Voriconazol não foi estudado em pacientes com cirrose hepática crônica grave (classe C de Child-Pugh).
Voriconazol foi associado a elevações dos testes da função hepática e a sinais clínicos de lesão hepática, tal como icterícia, e deve apenas ser utilizado em pacientes com insuficiência hepática grave somente quando o benefício superar o risco potencial. Os pacientes com insuficiência hepática grave devem ser cuidadosamente monitorados quanto à toxicidade do fármaco.
Uso em Crianças
Uso em Crianças (2 a < 12 anos) e Adolescentes (12 a 14 anos e < 50 kg)
O regime de dose recomendado é o seguinte:
| - | Oral |
|
Dose de ataque (nas primeiras 24 horas) |
Não recomendado |
|
Dose de manutenção (após as primeiras 24 horas) |
9 mg/kg a cada 12 horas (dose máxima de 350 mg a cada 12 horas) |
Nota: Baseado na análise de farmacocinética populacional em 112 pacientes pediátricos imunocomprometidos de 2 a <12 anos e 26 adolescentes imunocomprometidos de 12 a <17 anos.
Recomenda-se iniciar a terapia com o regime intravenoso e, o regime oral deve ser considerado somente após uma melhora clínica significante. Foi observado que uma dose intravenosa de 8 mg/kg fornecerá uma exposição ao Voriconazol aproximadamente 2 vezes maior que a dose oral de 9 mg/kg.
A dose oral recomendada para crianças é baseada em estudos onde Voriconazol foi administrado na forma de pó para suspensão oral. Não foi investigado em pacientes pediátricos a bioequivalência entre o pó para suspensão oral e comprimidos.
Considerando o limite assumido gastroentérico de tempo de trânsito em pacientes pediátricos, a absorção dos comprimidos pode ser diferente em pacientes pediátricos e adultos.
A segurança e a eficácia em pacientes pediátricos menores de 2 anos não foi estabelecida. Portanto, Voriconazol não é recomendado para crianças com menos de 2 anos de idade. O uso em pacientes pediátricos de 2 a <12 anos com insuficiência hepática ou renal não foi estudado.
Uso em todos os outros Adolescentes 12 a 14 anos e ≥ 50 kg; 15 a 16 anos independente do peso corpóreo)
O regime posológico de Voriconazol deve ser o mesmo indicado para os adultos.
Ajuste de Dose
Em pacientes com resposta inadequada, a dose pode ser aumentada em intervalos de 1 mg/kg (ou intervalos de 50 mg se a dose oral máxima de 350 mg foi usada inicialmente). Se os pacientes não conseguirem tolerar o tratamento, reduzir a dose em intervalos de 1 mg/kg (ou em intervalos de 50 mg se a dose oral máxima de 350 mg foi usada inicialmente).
Este medicamento não deve ser partido, aberto ou mastigado.
Injetável
Voriconazol pó liofilizado para solução injetável deve ser reconstituído e diluído antes da administração por infusão intravenosa. Não administrar por injeção em “bolus”.
Recomenda-se que Voriconazol, pó liofilizado para solução injetável, seja administrado a uma taxa de no máximo 3 mg/kg por hora, durante 1 a 3 horas.
Derivados Sanguíneos e Suplementação eletrolítica
Voriconazol não deve ser infundido concomitantemente com qualquer derivado sanguíneo ou qualquer infusão rápida de suplementação eletrolítica, ainda que as duas infusões estejam correndo em linhas intravenosas separadas (ou cânulas). Os distúrbios eletrolíticos tais como hipocalemia, hipomagnesemia e hipocalcemia devem ser monitorados e corrigidos, se necessário, antes do início e durante o tratamento com Voriconazol.
Solução eletrolítica intravenosa (não concentrada)
Voriconazol pode ser infundido simultaneamente com outras soluções eletrolíticas intravenosas (não concentradas), porém deve ser infundido através de linha separada.
Nutrição Parenteral Total (NPT)
Voriconazol pode ser infundido simultaneamente com nutrição parenteral total, porém deve ser infundido através de linha separada. Se a NTP for infundida através de cateter de múltiplo lúmen, é necessário que a NPT seja administrada utilizando-se um canal diferente daquele utilizado para Voriconazol.
Uso em Adultos
A terapia com Voriconazol, por via intravenosa deve ser iniciada com o regime de dose de ataque especificado, para se obter no Dia 1, concentrações plasmáticas adequadas. O tratamento intravenoso deve continuar por pelo menos 7 dias antes da troca para a terapia oral. Uma vez que o paciente está clinicamente melhor e torna-se tolerante a medicação administrada por via oral, o comprimido de voriconazol pode ser utilizado. Devido à alta biodisponibilidade oral (96%), a troca entre a administração intravenosa e a oral é adequada, quando indicada clinicamente.
Informações detalhadas das recomendações de dosagem são apresentadas na tabela a seguir:
|
Infecção |
Dose de Ataque (nas primeiras 24 horas) |
Dose de Manutençãoa |
|
Aspergilose invasivab |
6 mg/kg a cada 12 horas |
4 mg/kg a cada 12 horas |
|
Infecções invasivas graves por Candida, inclusive candidemia |
6 mg/kg a cada 12 horas |
3-4 mg/kg a cada 12 horasc |
|
Candidíase esofágica |
6 mg/kg a cada 12 horas |
Não recomendado (utilizar tratamento oral se possível) |
|
Scedosporioses e Fusarioses |
6 mg/kg a cada 12 horas |
4 mg/kg a cada 12 horas |
a. Em estudos com voluntários sadios, a dose oral de 200 mg a cada 12 horas resultou em uma exposição (AUCτ) similar à dose IV de 3 mg/kg a cada 12 horas, a dose oral de 300 mg a cada 12 horas resultou em uma exposição (AUCτ) similar à dose IV de 4 mg/kg a cada 12 horas.
b. Em um estudo clínico pivotal de aspergilose invasiva, a duração mediana do tratamento de voriconazol intravenoso foi de 10 dias (variação de 2 – 85 dias). A duração mediana da terapia oral de voriconazol foi de 76 dias (variação 2 – 232 dias).
c. Em estudos clínicos, pacientes com candidemia receberam como terapia inicial 3 mg/kg a cada 12 horas, enquanto pacientes com outras infecções profundas por Candida receberam 4 mg/kg como terapia de salvamento. Dose apropriada deve basear-se na gravidade e natureza da infecção.
Ajuste de Dose
Se os pacientes não tolerarem o tratamento de 4 mg/kg a cada 12 horas, reduzir a dose intravenosa de manutenção para o mínimo de 3 mg/kg a cada 12 horas.
A fenitoína pode ser coadministrada com voriconazol, se a dose de manutenção do Voriconazol for aumentada para 5 mg/kg por via intravenosa, a cada 12 horas.
Quando Voriconazol é coadministrado com doses ajustadas de efavirenz, a dose de manutenção de Voriconazol deve ser aumentada para 400 mg a cada 12 horas.
A duração do tratamento depende da resposta clínica e micológica dos pacientes. A duração do tratamento com a formulação intravenosa não deve ser superior a 6 meses.
Uso em Pacientes Idosos
Não é necessário ajuste da dose em pacientes idosos.
Uso em Pacientes com Insuficiência Renal
Em pacientes com insuficiência renal moderada a grave (clearance de creatinina < 50 mL/min) ocorre acúmulo do veículo utilizado na formulação intravenosa, SBECD (sulfobutil-éter β-ciclodextrina sódica). Nestes pacientes deve ser administrada a formulação oral de Voriconazol, exceto quando a avaliação de risco-benefício para o paciente justifique o uso da formulação intravenosa. As concentrações séricas de creatinina devem ser rigorosamente monitoradas nestes pacientes e se forem verificados aumentos, deve ser considerada a mudança para tratamento por via oral.
O voriconazol é hemodialisável com um clearance de 121 mL/min. Uma sessão de hemodiálise com a duração de 4 horas não remove uma quantidade de voriconazol suficiente que justifique um ajuste posológico.
O veículo intravenoso, SBECD, é hemodialisável com um clearance de 55 mL/min.
Uso em Pacientes com Insuficiência Hepática
Não é necessário ajuste de dose em pacientes com comprometimento hepático agudo, manifestado por elevação da função hepática detectada por testes (TGP/ALT, TGO/AST). Recomenda-se a monitoração contínua dos testes da função hepática para verificar elevações posteriores.
Para pacientes com cirrose hepática de grau leve a moderado (classe A e B de Child-Pugh), em tratamento com Voriconazol, recomenda-se o uso dos regimes de dose de ataque padrão, mas somente metade da dose de manutenção.
Voriconazol não foi estudado em pacientes com cirrose hepática crônica grave (classe C de Child-Pugh).
Voriconazol foi associado a elevações dos testes da função hepática e a sinais clínicos de lesão hepática, tal como icterícia e deve apenas ser utilizado em pacientes com insuficiência hepática grave somente quando o benefício superar o risco potencial. Os pacientes com insuficiência hepática grave devem ser cuidadosamente monitorados quanto à toxicidade do fármaco.
Uso em Crianças
Uso em Crianças (2 a < 12 anos) e Adolescentes (12 a 14 anos e < 50 kg)
O regime de dose recomendado é o seguinte:
| - |
Intravenosa |
|
Dose de ataque (nas primeiras 24 horas) |
9 mg/kg a cada 12 horas |
|
Dose de manutenção (após as primeiras 24 horas) |
8 mg/kg a cada 12 horas |
Nota: Baseado na análise de farmacocinética populacional em 112 pacientes pediátricos imunocomprometidos de 2 a <12 anos e 26 adolescentes imunocomprometidos de 12 a <17 anos.
Recomenda-se iniciar a terapia com o regime intravenoso e, o regime oral deve ser considerado somente após uma melhora clínica significante. Foi observado que uma dose intravenosa de 8 mg/kg fornecerá uma exposição ao Voriconazol aproximadamente 2 vezes maior que a dose oral de 9 mg/kg.
A segurança e a eficácia em pacientes pediátricos menores de 2 anos não foi estabelecida (vide item 3. Características Farmacológicas – Propriedades Farmacodinâmicas). Portanto, Voriconazol não é recomendado para crianças com menos de 2 anos de idade. O uso em pacientes pediátricos de 2 a <12 anos com insuficiência hepática ou renal não foi estudado.
Uso em todos os outros Adolescentes (12 a 14 anos e ≥ 50 kg; 15 a 16 anos independente do peso corpóreo)
O regime posológico de Voriconazol deve ser o mesmo indicado para os adultos.
Ajuste de Dose
Em pacientes com resposta inadequada, a dose pode ser aumentada em intervalos de 1 mg/kg (ou intervalos de 50 mg se a dose oral máxima de 350 mg foi usada inicialmente). Se os pacientes não conseguirem tolerar o tratamento, reduzir a dose em intervalos de 1 mg/kg (ou em intervalos de 50 mg se a dose oral máxima de 350 mg foi usada inicialmente).
Instruções para Administração
Voriconazol, pó liofilizado para solução injetável, é apresentado em frasco-ampola para uso único e qualquer solução não utilizada deve ser descartada. O conteúdo do frasco deve ser reconstituído com 19 mL de água para injetáveis, obtendo uma solução cristalina contendo 10 mg/mL de voriconazol e um volume extraível de 20 mL. Descarte o frasco-ampola de Voriconazol caso o vácuo não empurre o diluente para dentro do frasco. Antes da administração, o volume de solução reconstituída (vide tabela adiante) deve ser adicionado a um diluente de infusão compatível, recomendado a seguir, para produzir, quando apropriado, uma solução final de Voriconazol equivalente a 0,5-5 mg/mL de voriconazol.
Volumes Requeridos da solução reconstituída de Voriconazol 10 mg/mL
|
Peso Corporal (kg) |
Volume da Solução Reconstituída de Voriconazol (10 mg/mL) necessária para: |
||||
|
Dose de 3 mg/kg (número de frascos-ampola) |
Dose de 4 mg/kg (número de frascos-ampola) | Dose de 6 mg/kg (número de frascos-ampola) | Dose de 8 mg/kg (número de frascos-ampola) |
Dose de 9 mg/kg (número de frascos-ampola) |
|
|
10 |
- | 4,0 mL (1) | - | 8,0 mL (1) |
9,0 mL (1) |
| 15 | - | 6,0 mL (1) | - | 12,0 mL (1) |
13,5 mL (1) |
| 20 | - | 8,0 mL (1) | - | 16,0 mL (1) |
18,0 mL (1) |
| 25 | - | 10,0 mL (1) | - | 20,0 mL (1) |
22,5 mL (2) |
| 30 | 9,0 mL (1) | 12 mL (1) | 18 mL (1) | 24,0 mL (2) |
27,0 mL (2) |
| 35 | 10,5 mL (1) | 14 mL (1) | 21 mL (2) | 28,0 mL (2) |
31,5 mL (2) |
| 40 | 12,0 mL (1) | 16 mL (1) | 24 mL (2) | 32,0 mL (2) |
36,0 mL (2) |
| 45 | 13,5 mL (1) | 18 mL (1) | 27 mL (2) | 36,0 mL (2) |
40,5 mL (3) |
| 50 | 15,0 mL (1) | 20 mL (1) | 30 mL (2) | 40,0 mL (2) |
45,0 mL (3) |
| 55 | 16,5 mL (1) | 22 mL (2) | 33 mL (2) | 44,0 mL (3) |
49,5 mL (3) |
| 60 | 18,0 mL (1) | 24 mL (2) | 36 mL (2) | 48,0 mL (3) |
54,0 mL (3) |
| 65 | 19,5 mL (1) | 26 mL (2) |
39 mL (2) |
52,0 mL (3) |
58,5 mL (3) |
| 70 | 21,0 mL (2) | 28 mL (2) |
42 mL (3) |
- | - |
| 75 | 22,5 mL (2) | 30 mL (2) |
45 mL (3) |
- | - |
| 80 | 24,0 mL (2) | 32 mL (2) |
48 mL (3 |
- | - |
| 85 | 25,5 mL (2) | 34 mL (2) |
51 mL (3) |
- | - |
| 90 | 27,0 mL (2) | 36 mL (2) |
54 mL (3) |
- | - |
| 95 | 28,5 mL (2) | 38 mL (2) |
57 mL (3) |
- | - |
| 100 | 30,0 mL (2) | 40 mL (2) |
60 mL (3) |
- | - |
Voriconazol, pó liofilizado para solução injetável, após reconstituição e diluição, destina-se à administração por infusão intravenosa. Voriconazol não deve ser administrado como injeção em “bolus” ou injeção intramuscular.
Recomenda-se que Voriconazol, pó liofilizado para solução injetável, seja administrado a uma velocidade de infusão máxima equivalente a 3 mg/kg por hora, durante 1 a 2 horas.
Reconstituição
Preparar a solução inicial de Voriconazol, pó liofilizado para solução injetável, adicionando 19 mL de água para injetáveis ao frasco com o pó com 200 mg e agitar até completa dissolução. Cada mL da solução reconstituída contém 10 mg de voriconazol.
Os medicamentos para administração parenteral devem ser inspecionados visualmente quanto à presença de micropartículas antes da administração. Se houver evidência de micropartículas nos líquidos reconstituídos, a solução deve ser descartada.
Diluir essa solução imediatamente antes da administração.
Diluição
A solução reconstituída é compatível e pode ser diluída com as seguintes soluções:
- Cloreto de sódio 9 mg/mL (0,9%) para Infusão Intravenosa;
- Ringer lactato para infusão intravenosa;
- Glicose 5% e ringer lactato de sódio para infusão intravenosa;
- Glicose 5% e cloreto de sódio a 0,45% para Infusão Intravenosa;
- Glicose 5% para Infusão Intravenosa;
- Glicose 5% em 20 mEq de cloreto de potássio para Infusão Intravenosa;
- Cloreto de sódio 0,45% para Infusão Intravenosa;
- Glicose 5% e cloreto de sódio a 0,9% para Infusão Intravenosa.
A compatibilidade de voriconazol com outros diluentes que não os descritos acima, é desconhecida.
Incompatibilidades
Derivados sanguíneos e Suplementação eletrolítica
Voriconazol não deve ser infundido simultaneamente com qualquer derivado sanguíneo ou qualquer infusão rápida de suplementação eletrolítica, ainda que as duas infusões estejam correndo em linhas separadas (ou cânulas). Distúrbios eletrolíticos tais como hipocalemia, hipomagnesemia e hipocalcemia devem ser corrigidas antes do início do tratamento com Voriconazol.
Solução eletrolítica intravenosa (não concentrada)
Voriconazol pode ser infundido simultaneamente com outras soluções eletrolíticas intravenosas (não concentradas), porém deve ser infundido através de linha separada.
Nutrição Parenteral Total (NPT)
Voriconazol pode ser infundido simultaneamente com nutrição parenteral total, porém deve ser infundido através de linha separada. Se a NTP for infundida através de cateter de múltiplo lúmen, é necessário que a NTP seja administrada utilizando-se um canal diferente daquele utilizado para o voriconazol.
Voriconazol não deve ser diluído com infusão intravenosa de bicarbonato de sódio a 4,2%. A compatibilidade com outras concentrações é desconhecida.
Este medicamento não deve ser misturado com outros medicamentos, exceto aqueles mencionados no item “Diluição”.
Não adicionar medicação suplementar (exceto aquelas citadas no item “diluição”) ou utilizar a mesma linha intravenosa para administração de outra medicação simultaneamente.
Interação medicamentosa: quais os efeitos de tomar Voriconazol com outros remédios?
O voriconazol é metabolizado pelas e inibe a atividade das isoenzimas do citocromo P450 CYP2C19, CYP2C9 e CYP3A4. Inibidores ou indutores destas isoenzimas podem aumentar ou diminuir as concentrações plasmáticas de voriconazol, respectivamente, e existe potencial do voriconazol aumentar as concentrações plasmáticas de substâncias metabolizadas por estas isoenzimas do CYP450.
A não ser quando especificado de outro modo, estudos de interações medicamentosas foram realizados em homens adultos sadios usando administrações múltiplas até o estado de equilíbrio com voriconazol oral a 200 mg duas vezes ao dia. Estes resultados são relevantes para outras populações e vias de administração.
O voriconazol deve ser administrado com cuidado em pacientes com medicação concomitante que conhecidamente prolonga o intervalo QT. Quando também houver um potencial de voriconazol aumentar as concentrações plasmáticas de substâncias metabolizadas por isoenzimas da CYP3A4 (certos anti-histamínicos, quinidina, cisaprida, pimozida), a coadministração é contraindicada.
Tabela de interação
Interações entre voriconazol e outros medicamentos são relacionadas na tabela abaixo. (QD = uma vez ao dia, BID = duas vezes ao dia, TID = três vezes ao dia, e ND = não determinado). A direção da seta para cada parâmetro farmacocinético é baseada no intervalo de confiança de 90% da razão da média geométrica, sendo dentro (↔), abaixo (↓) ou acima (↑) da faixa de 80-125%. O asterisco (*) indica uma interação de duas vias. AUCT, AUCT e AUC0-∞ representam a área sob a curva de um intervalo de administração, do tempo zero até o tempo com medição detectável e do tempo zero até infinito, respectivamente.
As interações na tabela são apresentadas na seguinte ordem: contraindicações, aquelas que necessitam de ajuste da dose e monitoração clínica e/ou biológica cuidadosa e finalmente aquelas que não têm interação farmacocinética significativa, mas podem ser de interesse clínico neste campo terapêutico.
Qual a ação da substância do Voriconazol?
Resultados de Eficácia
Experiência Clínica
Nesta seção o sucesso do tratamento é definido em termos de resposta completa ou parcial.
Infecções por Aspergillus – Eficácia em pacientes com aspergilose com prognóstico desfavorável
O voriconazol apresenta atividade fungicida in vitro contra Aspergillus spp. A eficácia e o benefício em termos de sobrevida do voriconazol versus anfotericina B convencional no tratamento primário da aspergilose invasiva aguda foram demonstrados num estudo multicêntrico, aberto e randomizado, em 277 pacientes imunocomprometidos tratados durante 12 semanas. O voriconazol foi administrado intravenosamente com dose de ataque de 6 mg/kg a cada 12 horas nas primeiras 24 horas, seguido pela dose de manutenção de 4 mg/kg a cada 12 horas por no mínimo sete dias. A terapia poderia então ser alterada para a formulação oral na dose de 200 mg a cada 12 horas. A duração mediana da terapia IV de voriconazol foi de 10 dias (intervalo de 2 – 85 dias). Após a terapia intravenosa de voriconazol, a duração mediana da terapia oral de voriconazol foi de 76 dias (intervalo de 2 – 232 dias).
Foi observada uma resposta global satisfatória (resolução parcial ou completa de todos os sinais e sintomas atribuíveis, alterações radiográficas/broncoscópicas presentes inicialmente) em 53% dos pacientes tratados com voriconazol comparativamente a 31% dos pacientes tratados com o agente comparador. A taxa de sobrevida no dia 84 para o voriconazol foi estatística e significativamente superior ao registrado para o agente comparador, tendo sido observado um benefício clínico e estatisticamente significativo a favor do voriconazol, tanto para o tempo até a morte como para o tempo até a descontinuação devido à toxicidade.1
Este estudo confirma os resultados de um estudo anterior prospectivo, de resultado clínico positivo, em pacientes que apresentavam fatores de risco para um prognóstico desfavorável, incluindo doença do enxerto contra o hospedeiro e, em particular, infecções cerebrais (normalmente associadas a uma mortalidade de quase 100%).
Estes estudos incluíram pacientes com transplante de medula óssea e transplantados de órgãos sólidos, doenças hematológicas malignas, câncer e AIDS, com aspergilose cerebral, sinusal, pulmonar e disseminada.1
Infecções invasivas graves por Candida – Eficácia em pacientes não neutropênicos
A eficácia do voriconazol comparado ao regime de tratamento com anfotericina B, seguido de fluconazol no tratamento primário de candidemia foi demonstrada em um estudo comparativo aberto. Trezentos e setenta pacientes não neutropênicos com candidemia documentada (cultura sanguínea positiva e sinais clínicos de infecção) foram incluídos neste estudo, dos quais 248 foram tratados com voriconazol. A população de pacientes estava gravemente doente, com aproximadamente 50% internada na Unidade de Terapia Intensiva e 40% estavam sob ventilação mecânica no início do tratamento. A duração média do tratamento foi de 15 dias em ambos os braços do tratamento. Foi observada resposta com êxito (resolução/melhora de todos os sinais e sintomas clínicos da infecção, cultura sanguínea negativa para Candida, locais/tecidos infectados negativos para Candida) em 41% dos pacientes em ambos os braços de tratamento 12 semanas após o final da terapia (EOT).
Nesta análise, pacientes que não apresentavam melhora 12 semanas após o término do tratamento foram classificados como falha no tratamento. De acordo com uma análise secundária, que comparou as taxas de resposta no último ponto mais relevante para avaliação do paciente (EOT, ou 2, 6 ou 12 semanas após o EOT), o voriconazol e o regime de tratamento com anfotericina B seguido de fluconazol apresentaram taxas de resposta de 65% e 71%, respectivamente.2
Infecções refratárias graves por Candida
O estudo envolveu 55 pacientes com infecções sistêmicas refratárias graves por Candida (incluindo candidemia, candidíase disseminada e outras candidíases invasivas) em que o tratamento antifúngico anterior, particularmente com fluconazol, foi ineficaz. Foi observada resposta com êxito em 24 pacientes (15 respostas completas, 9 respostas parciais). Em espécies não albicans resistentes ao fluconazol obteve-se sucesso no tratamento de 3/3 infecções por C. krusei (respostas completas) e de 6/8 infecções por C. glabrata (5 respostas completas, 1 resposta parcial). Os dados de eficácia clínica foram baseados em dados de sensibilidade limitados.
Outros patógenos fúngicos raros graves
O voriconazol mostrou-se eficaz contra os seguintes patógenos fúngicos raros:
- Scedosporium spp. – foram observadas respostas satisfatórias na terapia com voriconazol em 16 de 28 pacientes (55%) com infecção por S. apiospermum e em 2 de 7 pacientes (29%) com infecções por S. prolificans. Além disso, foi observada resposta satisfatória em 1 de 3 pacientes com infecções causadas por mais do que um organismo;
- Fusarium spp. – sete dentre 17 pacientes (41%) foram tratados com sucesso com o voriconazol. Destes 7 pacientes, 3 infecções eram oculares, 1 nos seios da face e 3 disseminadas. Além destes, 4 outros pacientes com fusariose apresentaram infecção causada por diversos organismos, sendo que, para 2 deles, o resultado foi satisfatório.
A maioria dos pacientes medicados com voriconazol para as infecções raras acima mencionadas era intolerante ou refratária à terapêutica antifúngica anterior.
Estudos Clínicos em Pacientes Pediátricos
Sessenta e um pacientes pediátricos, com idades entre 9 meses e 15 anos, que apresentavam infecções fúngicas invasivas comprovadas ou prováveis, foram tratados com voriconazol. Esta população incluía 34 pacientes de 2 a < 12 anos de idade e 20 pacientes dos 12-15 anos de idade. Para a maioria (57/61), as terapias antifúngicas prévias foram ineficazes. Os estudos terapêuticos incluíram 5 pacientes com idades entre 12-15 anos; os outros pacientes receberam voriconazol nos estudos de uso compassionado. As doenças preexistentes nestes pacientes incluíam doença hematológica maligna e anemia aplástica (27 pacientes) e doença granulomatosa crônica (14 pacientes). A infecção fúngica mais frequentemente tratada foi a aspergilose (43/61; 70%).
Estudos Clínicos que Investigaram o Intervalo QT
Um estudo cruzado, placebo-controlado, randomizado, de dose única, para avaliar o efeito no intervalo QT em voluntários sadios foi conduzido com três doses orais de voriconazol e cetoconazol. Os aumentos máximos médios no intervalo QTc ajustados pelo placebo a partir do pré-tratamento, após 800, 1200 e 1600 mg de voriconazol foram de 5,1; 4,8 e 8,2 ms, respectivamente, e de 7,0 ms para 800 mg de cetoconazol. Nenhum voluntário de qualquer grupo apresentou um aumento no intervalo QTc ≥ 60 ms em relação ao pré-tratamento. Nenhum dos voluntários apresentou um intervalo que excedeu o limiar de prolongamento do intervalo QTc de relevância clínica de 500 ms.
Referências Bibliográficas
1. Pfizer Clinical Overview (Fluconazole DDI, Everolimus DDI, Rifabutin DDI, Eucast CSLI Breakpoints, DDI Table Format, Periostitis, Adult Dosing Clarification, and Pediatric Dosing update) January 2012.
2. Protocols 150-309 and 150-604 Summary: An Open Label, Non-Comparative, Multicentre, Phase III Trial of the Efficacy, Safety and Toleration of Voriconazole in the Primary or Secondary Treatment of Invasive Fungal Infections.
3. Final Study Report: Voriconazole Protocol A1501041. A Multi-Centre, Randomised, Single-blind, Single Dose, Placebo-Controlled, Five-Way Crossover Study To Investigate the Effect of Three Oral Doses of Voriconazole (800mg, 1200mg and 1600mg) and Active Comparator (Oral Ketoconazole 800mg) on QTc Interval in Healthy Subjects Aged 18 to 65 Years. Report Date: 24 February 2003.
4. Herbrecht, Raoul et al. Voriconazole Versus Amphotericin B For Primary Therapy Of Invasive Aspergillosis. N Engl J Med, Vol. 347, No. 6, pages 408-415. August, 2002.
5. Kullberg, B J. et al. Voriconazole versus a regimen of amphotericin B followed by fluconazole for candidaemia in non-neutropenic patients: a randomised non-inferiority trial. The Lancet, Vol. 366, No. 9495, pages 1435-1442. October, 2005.
6. Pfaller, MA et al. Progress in Antifungal Susceptibility Testing of Candida spp. by Use of Clinical and Laboratory Standards Institute Broth Microdilution Methods, 2010 to 2012. Journal of Clinical Microbiology. Setembro, 2012. 50(9): 2846-2856.
7. European Committee on Antimicrobial Susceptibility Testing (Eucast). Antifungal Agents. Breakpoint tables for interpretation of MICs. Version 7.0, valid from 2014-08-12.
Características Farmacológicas
Comprimido / Injetável
Propriedades Farmacodinâmicas
Mecanismo de Ação
O voriconazol é um agente antifúngico triazólico. O principal modo de ação de voriconazol está na inibição da desmetilação de 14-alfa-lanosterol mediada pelo citocromo P-450- fúngico, uma etapa essencial na biossíntese do ergosterol fúngico. O acúmulo de 14-alfa-metil-esterois está correlacionado com a subsequente perda de ergosterol na membrana celular fúngica e pode ser responsável pela atividade antifúngica de voriconazol. Foi demonstrado que voriconazol é mais seletivo para enzimas do citocromo P-450 fúngico do que para vários sistemas enzimáticos do citocromo P-450 de mamíferos.
Relação farmacocinética/farmacodinâmica
Em 10 estudos terapêuticos, a mediana para a concentração plasmática média e máxima em sujeitos individuais em todos os estudos foi 2.425 ng/mL (faixa interquartil de 1193 a 4.380 ng/mL) e 3.742 ng/mL (faixa interquartil de 2.027 a 6.302 ng/mL), respectivamente. Não foi encontrada uma associação positiva entre a concentração plasmática média, máxima ou mínima de voriconazol e a eficácia em estudos terapêuticos.
Análises farmacocinéticas-farmacodinâmicas de dados de ensaios clínicos identificaram associações positivas entre as concentrações plasmáticas de voriconazol e anormalidades de testes de função hepática e distúrbios visuais.
Microbiologia
In vitro, o voriconazol apresenta atividade antifúngica de amplo espectro contra as espécies de Candida (incluindo cepas resistentes ao fluconazol, C. krusei e as cepas resistentes de C. glabrata e C. albicans) e atividade fungicida contra todas as espécies de Aspergillus testadas. Além disso, o voriconazol apresenta atividade fungicida in vitro contra patógenos fúngicos emergentes, incluindo o Scedosporium ou o Fusarium, que apresentam sensibilidade limitada aos agentes antifúngicos existentes.
A eficácia clínica (com resposta completa ou parcial, vide item Resultados de Eficácia) foi demonstrada contra Aspergillus spp. incluindo A. flavus, A. fumigatus, A. terreus, A. niger, A. nidulans; contra Candida spp., incluindo C. albicans, C. glabrata, C. krusei, C. parapsilosis, C. tropicalis, e um número limitado de C. dubliniensis, C. inconspicua e C. guilliermondii; e contra Scedosporium spp., incluindo S. apiospermum, S. prolificans e Fusarium spp.
Outras infecções fúngicas tratadas (com frequente resposta completa ou parcial) incluíram casos isolados de Alternaria spp., Blastomyces dermatitidis, Blastoschizomyces capitatus, Cladosporium spp., Coccidioides immitis, Conidiobolus coronatus, Cryptococcus neoformans, Exserohilum rostratum, Exophiala spinifera, Fonsecaea pedrosoi, Madurella mycetomatis, Paecilomyces lilacinus, Penicillium spp., incluindo P. marneffei, Phialophora richardsiae, Scopulariopsis brevicaulis e Trichosporon spp., incluindo infecções por T. beigelii. A atividade in vitro contra isolados clínicos foi observada para Acremonium spp., Alternaria spp., Bipolaris spp., Cladophialophora spp., Histoplasma capsulatum, sendo a maioria das cepas inibidas por concentrações de voriconazol que variaram de 0,05 a 2 mcg/mL.
Foi observada atividade in vitro contra os seguintes patógenos, porém, a significância clínica é desconhecida: Curvularia spp. e Sporothrix spp.
Teste de Suscetibilidade
Os espécimes para cultura fúngica e outros estudos laboratoriais relevantes (sorologia, histopatologia) devem ser obtidos antes da terapia, para se isolar e identificar os organismos causadores. A terapia pode ser iniciada antes que os resultados das culturas e outros estudos laboratoriais sejam conhecidos; entretanto, uma vez que estes resultados se tornem disponíveis, a terapia anti-infectiva deve ser ajustada apropriadamente.
As espécies mais frequentemente envolvidas na causa de infecções humanas incluem C. albicans, C. parapsilosis, C. tropicalis, C. glabrata e C. krusei, todas as quais geralmente exibem concentrações inibitórias mínimas (CIMs) de menos de 1 mg/mL para voriconazol.
Entretanto, a atividade in vitro de voriconazol contra espécies de Candida não é uniforme. Especificamente, para C. glabrata, as CIMs de voriconazol para isolados resistentes a fluconazol são proporcionalmente maiores do que aquelas de isolados suscetíveis a fluconazol. Por isto, devem envidados todos os esforços para identificar a espécie de Candida. Se existir teste de suscetibilidade antifúngica, os resultados de CIMs podem ser interpretados usando os critérios de limites de suscetibilidade (breakpoints).
Limites de suscetibilidade (breakpoints) do European Committee on Antimicrobial Suscetibility Testing (EUCAST)
Espécies de Candida
Os padrões de interpretação de voriconazol contra espécies de Candida são aplicáveis somente a testes realizados pelo método de referência de diluição de micromeios líquidos EUCAST para concentrações inibitórias mínimas (CIMs) lidas após 24 horas.
Critérios de limites de suscetibilidade (breakpoints) estabelecidos pelo EUCAST
|
Espécies de Candida |
CIM do breakpoint (mg/L) |
|
| ≤S (Suscetível) |
>R (Resistente) |
|
|
Candida albicans1 |
0,125 |
0,125 |
|
Candida tropicalis1 |
0,125 |
0,125 |
|
Candida parapsilosis1 |
0,125 |
0,125 |
|
Candida glabrata2 |
Evidência insuficiente |
|
|
Candida krusei3 |
Evidência insuficiente |
|
|
Outra Candida spp.4 |
Evidência insuficiente |
|
1 Cepas com valores de CIM acima do limite de suscetibilidade (S) são raras ou ainda não relatadas. Os testes de identificação e de suscetibilidade em qualquer isolado deste tipo devem ser repetidos e se o resultado for confirmado, o isolado deve ser enviado a um laboratório de referência.
2 Em estudos clínicos a resposta ao voriconazol em pacientes com infecções por C. glabrata foi 21% menor em comparação com C. albicans, C. parapsilosis e C. tropicalis. Entretanto, esta resposta reduzida não estava correlacionada com CIMs elevadas.
3 Em estudos clínicos a resposta ao voriconazol em infecções por C. krusei foi semelhante a C. albicans, C. parapsilosis e C. tropicalis. Entretanto, como existem somente 9 casos para análise de EUCAST, atualmente existem evidências insuficientes para estabelecer limites de suscetibilidade clínicos para C. krusei.
4 EUCAST não determinou limites de suscetibilidade não relacionados a espécies para voriconazol.
Limites de suscetibilidade (breakpoints) do Clinical and Laboratory Standards Institute (CLSI)
Critérios de limites de suscetibilidade (breakpoints) estabelecidos pelo CLSI
Métodos dos testes de suscetibilidade
Espécies de Aspergillus e outros fungos filamentosos
Não foram estabelecidos critérios interpretativos para espécies de Aspergillus e outros fungos filamentosos.
Espécies de Candida
Os padrões interpretativos para voriconazol contra espécies de Candida se aplicam somente a testes realizados usando o método de referência de microdiluição M 27 do Clinical and Laboratory Standards Institute (CLSI) lidos após 48 horas ou o método de referência de difusão em disco M44 para diâmetro da zona lido após 24 horas.
Técnicas de Diluição de meios líquidos
Métodos quantitativos são usados para determinar concentrações inibitórias mínimas (CIMs) antifúngicas. Estas CIMs fornecem uma estimativa da suscetibilidade de espécies de Candida a agentes antifúngicos. Os CIMs devem ser determinados utilizando-se procedimentos padrões após 48 horas. Procedimentos padrões são baseados num método de microdiluição ou concentração de inoculação padronizada e concentrações padronizadas de voriconazol pó. Os valores da CIMs devem ser interpretados de acordo com os critérios fornecidos na tabela abaixo.
Técnicas de Difusão
Métodos qualitativos que requerem medida da zona de diâmetro também fornecem estimativas reprodutíveis da suscetibilidade de espécies Candida a um agente antifúngico. Um dos procedimentos padrões requer o uso de concentrações padronizadas de inóculo e discos impregnados com 1 mcg de voriconazol para testar a suscetibilidade de leveduras ao voriconazol. Os critérios interpretativos dos discos também são fornecidos na tabela a seguir.
Critérios para Interpretação da Suscetibilidade ao voriconazol
| - |
Diluição do meio após 48 horas (CIM em mcg/mL) |
Difusão do Disco após 24 horas (zona de diâmetro em mm) |
||||
|
Suscetível (S) |
Suscetibilidade dosedependente (SDD) |
Resistente (R) | Suscetível (S) | Suscetibilidade dose-dependente (SDD) |
Resistente (R) |
|
|
Voriconazol |
≤ 1,0 | 2,0 | ≥ 4,0 | ≥ 17 | 14-16 |
≤ 13 |
Obs. 1: os breakpoints (mcg/mL) para voriconazol contra espécies Candida são mostrados. Se CIMs são medidas usando uma escala que resulta em cepas entre as categorias, a cepa está envolvida na próxima categoria mais alta. Assim, um isolado com CIM de voriconazol de 1,5 mcg/mL seria classificado na categoria S-DD.
A categoria de suscetibilidade implica que isolados são inibidos pelas concentrações geralmente alcançadas com os agentes antifúngicos testados quando a dosagem recomendada é utilizada no local da infecção. A categoria suscetível dose-dependente implica que uma infecção devido a um isolado pode ser tratada apropriadamente em locais do corpo onde os medicamentos estão fisiologicamente concentrados ou quando é administrada uma alta dose. A categoria resistente implica que isolados não são inibidos pelas concentrações geralmente alcançadas pelo agente com o esquema de dosagem normal e a eficácia clínica do agente contra o isolado não foi demonstrada em estudos.
Controle de Qualidade
Procedimentos de testes padrões de suscetibilidade requerem o uso de organismos de controle de qualidade para controlar os aspectos técnicos dos procedimentos dos testes. Pó padrão de voriconazol e discos de 1 mcg devem fornecer a seguinte faixa de valores na tabela abaixo.
Obs.: controle de qualidade de microrganismos é específico para cada cepa de organismo com propriedades biológicas intrínsecas relacionadas a mecanismos de resistência e sua expressão genética dentro do fungo, cepas específicas usadas para controle microbiológico não são clinicamente significativas.
Variações Aceitáveis no Controle de Qualidade para voriconazol a ser usado na Validação dos Resultados dos Testes de Suscetibilidade
| - |
Diluição do Meio (CIM em mcg/mL) |
Difusão de Disco (diâmetro de zona em mm) 24 horas |
|
|
24 horas |
48 horas | ||
|
Cepa QC |
|||
|
Candida parapsilosis |
0,016 – 0,12 | 0,03 – 0,25 |
28 – 37 |
|
Candida krusei |
0,06 – 0,5 | 0,12 – 1,0 |
16 – 25 |
|
Candida albicans |
* | * |
31 – 42 |
* Os limites do controle de qualidade não foram estabelecidos para esta cepa/combinação de agente antifúngico devido a sua extensa variação interlaboratorial durante estudos de controle de qualidade iniciais.
ATCC é uma marca registrada da American Type Culture Collection.
Propriedades Farmacocinéticas
Características Farmacocinéticas Gerais
A farmacocinética do voriconazol foi caracterizada em indivíduos sadios, populações especiais e nos pacientes portadores de infecções fúngicas. Durante a administração oral de 200 mg ou 300 mg, a cada 12 horas, por 14 dias, em pacientes com risco de aspergilose (principalmente pacientes com neoplasias malignas do tecido linfático ou hematopoiético), as características farmacocinéticas observadas de absorção rápida e consistente, acúmulo e farmacocinética não-linear, estiveram de acordo com aquelas observadas em indivíduos sadios.
A farmacocinética do voriconazol é não-linear, devido à saturação do seu metabolismo. Observa-se um aumento proporcionalmente maior na exposição com o aumento da dose. Estima-se que, em média, aumentando-se a dose oral de 200 mg a cada 12 horas para 300 mg a cada 12 horas, promoveremos um aumento aproximado de 2,5 vezes na exposição (AUCτ). A dose oral de manutenção de 200 mg (ou 100 mg para pacientes com peso inferior a 40 kg) atinge uma exposição de voriconazol similar à dose IV de 3mg/kg. A dose oral de manutenção de 300 mg (ou 150 mg para indivíduos com peso inferior a 40 kg) atinge uma exposição similar à dose IV de 4 mg/kg (vide tabela abaixo).
Parâmetros farmacocinéticos de voriconazol em adultos recebendo diferentes regimes de dose
|
Média geométrica (CV%)a |
6 mg/kg IV (dose de ataque) | 3 mg/kg IV Q12h | 4 mg/kg IV Q12h | 400 mg Oral (dose de ataque) | 200 mg Oral Q12h |
300 mg Oral Q12h |
|
n |
35 | 23 | 40 | 17 | 48 | 16 |
|
AUC12 (μg∙h/mL) |
13,9 (32) | 13,7 (53) | 33,9 (54) | 9,31 (38) | 12,4 (78) |
34,0 (53) |
|
Cmáx (μg/mL) |
3,13 (20) | 3,03 (25) | 4,77 (36) | 2,30 (19) | 2,31 (48) |
4,74 (35) |
|
Cmín (μg/mL) |
- | 0,46 (97) | 1,73 (74) | - | 0,46 (120) |
1,63 (79) |
a Parâmetros foram estimados com base na análise não-compartimental de 5 estudos farmacocinéticos.
AUC12 = área sob a curva de intervalo entre as doses durante 12 horas, Cmáx = concentração plasmática máxima, Cmín = concentração plasmática mínima, Q12h = a cada 12 horas.
Quando são administrados os regimes de dose de ataque intravenoso ou oral recomendados, obtêm-se concentrações plasmáticas próximas do estado de equilíbrio dentro das primeiras 24 horas após a dosagem (por exemplo: 6 mg/kg por via intravenosa a cada 12 horas no Dia 1 seguido de 3 mg/kg por via intravenosa a cada 12 horas; 400 mg por via oral a cada 12 horas no dia 1 seguido de 200 mg por via oral a cada 12 horas). Sem a dose de ataque, o acúmulo ocorre durante a terapia de doses múltiplas a cada 12 horas, com as concentrações plasmáticas de voriconazol no estado de equilíbrio sendo atingidas por volta do 6° dia, na maioria dos pacientes.
Distribuição
O volume de distribuição do voriconazol no estado de equilíbrio é estimado em 4,6 L/kg, sugerindo uma extensa distribuição nos tecidos. A ligação às proteínas plasmáticas é estimada em 58%.
Num programa de uso compassionado, as amostras do líquido cefalorraquidiano de 8 pacientes apresentaram concentrações detectáveis de voriconazol em todos estes pacientes.
Metabolismo
Estudos in vitro mostraram que o voriconazol é metabolizado pelas isoenzimas hepáticas do citocromo P450, CYP2C19, CYP2C9 e CYP3A4.
A variabilidade da farmacocinética do voriconazol entre indivíduos é elevada.
Estudos in vivo indicaram que a CYP2C19 está significativamente envolvida no metabolismo do voriconazol. Esta enzima exibe polimorfismo genético. Por exemplo, espera-se que uma porcentagem de 15-20% das populações asiáticas apresente baixos níveis de metabolização. Para caucasianos e negros, a prevalência de indivíduos com baixos níveis de metabolização é de 3-5%. Os estudos realizados em indivíduos sadios caucasianos e japoneses demonstraram que indivíduos com baixos níveis de metabolização apresentam, em média, índices 4 vezes mais elevados de exposição ao voriconazol (AUCτ) quando comparados aos indivíduos homozigotos que apresentam metabolização extensa. Indivíduos heterozigotos que apresentam metabolização extensa do voriconazol demonstram, em média, índices 2 vezes mais elevados de exposição do que os indivíduos homozigotos que sejam metabolizadores extensos.
O principal metabólito do voriconazol é o N-óxido, que representa 72% dos metabólitos radiomarcados circulantes no plasma. Este metabólito tem atividade antifúngica mínima e não contribui para a eficácia geral do voriconazol.
Excreção
O voriconazol é eliminado através do metabolismo hepático, sendo que menos de 2% da dose é excretada pela urina, sob forma inalterada.
Após a administração de uma dose de voriconazol radiomarcado, aproximadamente 80% da radioatividade é recuperada na urina após administração múltipla intravenosa e 83% após administração múltipla oral. A maior parte da radioatividade total (> 94%) é excretada nas primeiras 96 horas após a administração oral ou intravenosa.
A meia-vida terminal do voriconazol depende da dose e é de aproximadamente 6 horas para 200 mg (oral). Devido à farmacocinética não-linear, a meia-vida terminal não pode ser utilizada na previsão do acúmulo ou da eliminação do voriconazol.
Farmacocinética em Grupos de Pacientes Especiais
Sexo
Em um estudo de dose múltipla oral, os valores de Cmáx e AUCτ para mulheres jovens sadias foram, respectivamente, 83% e 113% mais elevados do que em homens jovens sadios (18-45 anos) após a administração do comprimido. No mesmo estudo, não foram observadas diferenças significativas na Cmáx e na AUCτ entre homens idosos sadios e mulheres idosas sadias (> 65 anos). A Cmín do voriconazol no estado de equilíbrio em mulheres foi 100% superior a de homens recebendo comprimidos.
No programa clínico, nenhum ajuste de dose foi realizado em função do sexo. O perfil de segurança e as concentrações plasmáticas observadas em pacientes homens e mulheres foram semelhantes. Portanto, o ajuste na dose não se faz necessário, com base no sexo.
Idosos
Em um estudo de dose múltipla oral, a Cmáx e a AUCτ em homens idosos sadios (> 65 anos) foram, respectivamente, 61% e 86% mais elevadas do que em homens jovens sadios (18-45 anos). Não foram observadas diferenças significativas na Cmáx e na AUCτ entre mulheres idosas sadias (> 65 anos) e mulheres jovens sadias (18-45 anos).
Nos estudos terapêuticos, não foi efetuado ajuste de dose com base na idade. Foi observada uma relação entre as concentrações plasmáticas e a idade. No entanto, o perfil de segurança do voriconazol em pacientes jovens e idosos foi similar e, portanto, não é necessário ajuste na dosagem para pacientes idosos.
Crianças
As doses recomendadas para pacientes pediátricos e adolescentes são baseadas na análise da farmacocinética populacional dos dados compilados a partir de 112 pacientes pediátricos imunocomprometidos de 2 a < 12 anos e, 26 pacientes adolescentes imunocomprometidos de 12 a < 17 anos. Doses intravenosas múltiplas de 3, 4, 6, 7 e 8 mg/kg a cada 12 horas e doses múltiplas orais (usando a formulação pó para suspensão oral) de 4 mg/kg, 6 mg/kg e 200 mg a cada 12 horas foram avaliadas em 3 estudos de farmacocinética pediátrica. A dose de ataque intravenosa de 6 mg/kg IV a cada 12 horas no Dia 1 seguida da dose intravenosa de 4 mg/kg a cada 12 horas e comprimidos orais de 300 mg a cada 12 horas foi avaliada em um estudo de farmacocinética em adolescentes. A maior variabilidade inter-individual foi observada em pacientes pediátricos comparados a adultos.
Uma comparação entre os dados farmacocinéticos pediátricos e da população adulta indicaram que a exposição total prevista (AUCτ) em crianças após a administração de uma dose de ataque IV de 9 mg/kg foi comparável ao de adultos após uma dose de ataque IV de 6 mg/kg. As exposições totais previstas em crianças seguindo a dose de manutenção IV de 4 e 8 mg/kg a cada 12 horas foram comparáveis aos adultos após 3 e 4 mg/kg IV a cada 12 horas, respectivamente. A exposição total prevista em crianças, após uma dose oral de manutenção de 9 mg/kg (máximo de 350 mg) a cada 12 horas foi comparável ao dos adultos seguindo 200 mg por via oral a cada 12 horas. Uma dose intravenosa de 8 mg/kg proporcionará a exposição ao voriconazol aproximadamente 2 vezes maior do que uma dose oral de 9 mg/kg.
A maior dose de manutenção intravenosa em pacientes pediátricos em comparação a dos adultos reflete a maior capacidade de eliminação dos pacientes pediátricos devido a maior razão entre a massa hepática e a massa corpórea. A biodisponibilidade oral pode, no entanto, estar limitada em pacientes pediátricos com má-absorção e peso corporal muito baixo para a idade. Neste caso, recomenda-se a administração de voriconazol intravenoso.
Exposições ao voriconazol na maioria dos pacientes adolescentes foram comparáveis a dos adultos recebendo os mesmos regimes de dosagem. No entanto, a menor exposição ao voriconazol foi observada em alguns jovens adolescentes com baixo peso corporal em relação aos adultos. É provável que estes sujeitos metabolizem o voriconazol de forma mais semelhante às crianças do que adultos. Com base na análise farmacocinética da população, adolescentes de 12 a 14 anos de idade, com peso inferior a 50 kg devem receber doses das crianças.
Insuficiência Renal
Em um estudo de dose única oral (200 mg) em pacientes com função renal normal e com disfunção renal entre leve (clearance de creatinina 41-60 mL/min) a grave (clearance de creatinina < 20 mL/min), verificou-se que a farmacocinética do voriconazol não foi afetada significativamente pela insuficiência renal. A ligação do voriconazol às proteínas plasmáticas foi similar em pacientes com diferentes graus de insuficiência renal.
Insuficiência Hepática
Após uma dose única oral (200 mg), o valor da AUC foi 233% maior em pacientes com cirrose hepática de grau leve a moderado (classe A e B de Child-Pugh), quando comparado ao valor de indivíduos com função hepática normal. A ligação proteica do voriconazol não foi afetada pela função hepática comprometida.
Em um estudo de dose múltipla oral, a AUCτ de pacientes com cirrose hepática moderada (classe B de ChildPugh) que receberam doses de manutenção de 100 mg, a cada 12 horas, foi similar a de pacientes com função hepática normal que receberam 200 mg, a cada 12 horas. Dados de farmacocinética em pacientes com cirrose hepática grave (classe C de Child-Pugh) não estão disponíveis. Para informações sobre dosagem, vide item Como usar o Voriconazol? – Uso em Pacientes com Insuficiência Hepática.
Exclusivo Comprimido
Absorção
O voriconazol é rápida e quase completamente absorvido após a administração oral, sendo obtida a concentração plasmática máxima (Cmáx) em 1-2 horas após a administração. A biodisponibilidade do voriconazol após administração oral é estimada em 96%. Quando doses múltiplas de voriconazol são administradas com refeições com alto teor de gordura, os valores de Cmáx e AUCτ são reduzidos em 34% e 24%, respectivamente, quando administradas na forma de comprimidos. A absorção do voriconazol não é afetada por mudanças no pH gástrico.
Dados de Segurança Pré-Clínicos
Os estudos de toxicidade por doses repetidas com voriconazol revelaram que o fígado é o órgão-alvo. À semelhança de outros agentes antifúngicos, ocorreu hepatotoxicidade com exposições plasmáticas semelhantes às obtidas com doses terapêuticas no ser humano. Em ratos, camundongos e cães, o voriconazol também induziu alterações suprarrenais mínimas. Estudos convencionais de segurança farmacológica, genotoxicidade ou potencial carcinogênico não revelaram perigo especial para o ser humano.
Nos estudos de reprodução, o voriconazol mostrou-se teratogênico em ratos e embriotóxico em coelhos para exposições sistêmicas iguais as obtidas no ser humano após administração de doses terapêuticas. No estudo de desenvolvimento pré e pós-natal em ratos para exposições inferiores as obtidas no ser humano com administração de doses terapêuticas, o voriconazol prolongou a duração da gestação e do trabalho de parto e produziu distocia, com consequente mortalidade materna e redução da sobrevivência perinatal dos filhotes. Estes efeitos no trabalho de parto são provavelmente mediados por mecanismos espécie-específicos, envolvendo redução dos níveis de estradiol, e são consistentes com aqueles observados com outros agentes antifúngicos azólicos.
A administração de voriconazol não induziu nenhum comprometimento da fertilidade masculina ou feminina em ratos em exposições semelhantes àquelas obtidas em humanos em doses terapêuticas.
Exclusivo Injetável
Dados pré-clínicos do veículo intravenoso, SBECD, em estudos de toxicidade com dose repetida, indicam que os principais efeitos foram a vacuolização do epitélio do trato urinário e ativação dos macrófagos hepáticos e pulmonares
Fontes consultadas
- Bula do Profissional do Medicamento Vfend®.
Doenças relacionadas
Quer saber mais?
Consulta também a Bula do Voriconazol
Ler a bula do Voriconazol completa