Ddavp
Ferring
Bula do Ddavp
Ddavp® está destinado para:
Ddavp® spray nasal
- Tratamento de Diabetes insipidus central;
- Teste de capacidade de concentração renal.
Ddavp® solução nasal
- Tratamento de Diabetes insipidus central;
- Tratamento de poliúria (eliminação excessiva de urina) / polidipsia (sede excessiva) pós-hipofisectomia;
- Diagnóstico de diabetes insipidus central;
- Teste de função renal.
Ddavp® é uma medicação antidiurética, que reduz a eliminação de água do organismo.
Todas as apresentações de Ddavp® atuam sobre os rins, suprindo a deficiência de vasopressina natural, substância produzida por uma glândula do organismo chamada hipófise.
O tempo médio para início da ação é de aproximadamente 1 hora. Uma dose intranasal de 10 a 20 mcg possui efeito durante 8 a 12 horas.
Ddavp® não deve ser utilizado caso a resposta para algumas das perguntas a seguir for “sim”:
- Você possui polidipsia habitual e psicogênica (sensação de muita sede, acompanhada por produção de grande quantidade de urina)?
- Você possui histórico ou suspeita de insuficiência cardíaca e outras condições que requerem tratamento com agentes diuréticos?
- Você está com a quantidade de sódio no sangue abaixo do normal?
- Você possui insuficiência renal (redução da função dos rins) moderada a severa?
- Você possui síndrome de secreção inapropriada de HAD (hormônio antidiurético)?
- Você possui hipersensibilidade à desmopressina ou a qualquer componente da fórmula?
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
Spray nasal
Ddavp® spray e solução nasal devem ser utilizados por via intranasal.
O paciente deve assoar o nariz antes de utilizar o spray.
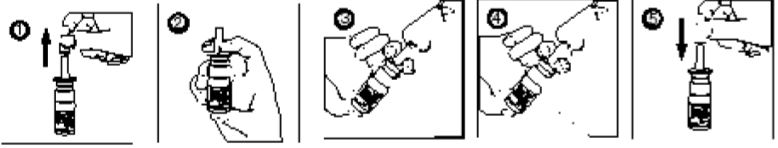
- Remova a tampa protetora do aplicador;
- Verifique se o final do tubo que está dentro do frasco está mergulhado no líquido;
- Segure o frasco de modo que o dedo polegar fique apoiado na sua base e o aplicador fique entre os dedos indicador e médio;
- Incline a cabeça para trás levemente. Insira o aplicador nasal em uma das narinas. Prenda a respiração quando administrar a dose;
- Se for prescrita mais de uma dose, repita a aplicação na outra narina. Use as narinas alternadamente para cada dose adicional;
- Recoloque a tampa protetora. Sempre armazene o frasco em pé.
Se houver qualquer dúvida com relação à dose administrada, o spray não deve ser administrado novamente até a próxima dose.
Em crianças, a administração deve ser realizada sob a supervisão de um adulto, de modo a garantir a dose adequada.
Antes de usar Ddavp® spray nasal pela primeira vez, a válvula deve ser pressionada 4 vezes, ou até que um jato homogêneo seja obtido. Caso Ddavp® spray nasal não tenha sido utilizado durante a última semana, é necessário pressionar a válvula uma vez, ou até que um jato homogêneo seja obtido.
Dosagem
Uma dose (borrifada) do spray equivale a 0,1 mL que corresponde a 10 mcg de acetato de desmopressina.
Diabetes insipidus central
- A dose é individualizada, mas a experiência clínica tem mostrado que a dose média diária em adultos é de 10 a 20 mcg (1 a 2 borrifadas) 1 a 2 vezes ao dia. Pode ser administrada como uma dose única ou dividida em duas ou três doses. Para crianças a dose média diária é de 10 mcg 1 a 2 vezes ao dia.
Teste de capacidade de concentração renal
- A dose habitual para adultos é de 40 mcg. Para crianças acima de 1 ano, a dose é de 10 a 20 mcg. Para crianças abaixo de 1 ano, a dose é 10 mcg. Após a administração de Ddavp®, qualquer possível urina dentro de uma hora é descartada. Durante as próximas 8 horas, duas porções de urina são coletadas para a medida de osmolalidade. Uma ingestão restrita de água deve ser observada. O nível de referência para osmolalidade normal da urina após a administração de Ddavp® é de 800 mOsm/Kg para a maioria dos pacientes. Com valores abaixo deste nível, o teste deve ser repetido. Um novo resultado baixo indica uma capacidade prejudicada em concentrar a urina e o paciente deve ser encaminhado para outros exames, a fim de se descobrir a causa do mau funcionamento.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Solução nasal
Ddavp® spray e solução nasal devem ser utilizados por via intranasal.
- Puxe a etiqueta plástica no gargalo do frasco.
- Quebre o lacre e retire a tampa plástica.
- Desenrosque a tampa pequena do gotejador. Use a mesma tampa no sentido inverso para evitar vazamento, especialmente se o frasco não for guardado em pé.
- Segure a parte graduada no túbulo plástico com uma mão e coloque os dedos da outra mão em torno da parte cilíndrica do gotejador. Coloque a ponta do gotejador para baixo contra a extremidade do túbulo marcada com uma seta e comprima o gotejador até que a solução atinja a graduação desejada. Se houver dificuldade no enchimento do túbulo, pode-se usar seringa de diabetes ou tuberculina para retirar a dose e encher o túbulo.
- Segure o túbulo com os dedos a aproximadamente 2,0 cm da extremidade e introduza-o em uma narina até que as pontas dos dedos atinjam a narina.
- Coloque a outra extremidade do túbulo na boca. Prenda a respiração, incline a cabeça para trás e, em seguida, sopre fortemente pelo túbulo de modo que a solução atinja o local exato na cavidade nasal. Este procedimento permite que a medicação fique limitada à cavidade nasal e não passe para a garganta.
- Após o uso feche a tampa plástica. Lave o túbulo com água e sacuda vigorosamente até retirar completamente a água contida no túbulo. O túbulo pode então ser usado para a aplicação seguinte.
- Verificar com o médico se o procedimento correto de administração está sendo empregado antes de tratamento continuado com Ddavp®.
Dosagem
Uma marca no túbulo plástico (0,05 mL) corresponde a 5 mcg de acetato de desmopressina.
Tratamento do diabetes insipidus central
Usualmente
- Adultos: 0,1 a 0,2 mL (10 a 20 mcg) diariamente, em dose única ou em duas doses diárias.
- Crianças (3 meses a 12 anos): a dose usualmente administrada é de 0,05 a 0,1 mL (5 a 10 mcg) diariamente, em dose única ou em duas doses.
Diagnóstico do diabetes insipidus central
- Inicialmente, pacientes adultos devem receber 1 litro de água por via oral, e o fluxo urinário deve ser estabilizado pela administração oral de líquido, equivalente em volume à urina eliminada. Então, administra-se 10 a 20 mcg de solução nasal de Ddavp®, 1 a 2 vezes ao dia. Para crianças 5 a 10 mcg, 1 a 2 vezes ao dia.
- Se o paciente tiver diabetes insipidus sensível à vasopressina, observa-se intensa redução no fluxo urinário e aumento da osmolalidade urinária dentro de 2 horas.
Teste de capacidade de concentração renal
- Em adultos e crianças com a função renal normal, espera-se atingir concentrações urinárias acima de 700 mOsm/Kg em 5 a 9 horas após a administração de Ddavp® intranasal de 40 mcg para adultos e 20 mcg para crianças acima de 1 ano de idade e 10 mcg para crianças abaixo de 1 ano de idade.
- Em recém-nascidos normais, concentração urinária de 600 mOsm/Kg deve ser obtida nas 5 horas seguintes à administração. Os recém-nascidos devem receber 10 mcg de Ddavp® intranasal e ter a ingestão de líquidos nas duas refeições seguintes à administração restrita a 50% da ingestão habitual, de modo a evitar sobrecarga hídrica.
Qualquer urina excretada na primeira hora após a administração de Ddavp®, deve ser descartada; após 8 horas da administração, devem-se coletar duas porções da urina para teste de osmolalidade.
Siga a orientação de seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Não interrompa o tratamento sem o conhecimento do seu médico.
Caso ocorra esquecimento de administração, entrar em contato com o médico.
Em caso de dúvidas, procure orientação do farmacêutico ou de seu médico, ou cirurgião-dentista.
Quando Ddavp® spray e solução nasal forem prescritos, recomendam-se os seguintes cuidados:
- Iniciar sempre com a menor dose;
- Seguir rigorosamente as instruções de restrição de líquidos;
- Caso necessário, o médico irá aumentar a dose progressivamente e com cuidado;
- Assegurar que a administração em crianças está sob a supervisão de um adulto para controlar o uso da dose.
O tratamento sem a concomitante redução de ingestão de líquidos pode levar à retenção de água e/ou hiponatremia (redução do sódio no sangue) acompanhada ou não de sintomas (dor de cabeça, náusea / vômito, ganho de peso e, em casos mais graves, convulsões).
Os pacientes e, quando aplicável, seus cuidadores, devem ser cuidadosamente intruídos a aderir à restrição de fluidos.
Quando usado com propósitos de diagnóstico, para o teste de concentração renal, a ingestão de fluidos não deve exceder meio litro para saciar a sede uma hora antes e até pelo menos oito horas após a administração. O teste de capacidade de concentração renal realizado em crianças abaixo de 1 ano de idade deve ser realizado sob supervisão cuidadosa em hospital.
Deve-se avaliar a presença de disfunção severa ou obstrução na bexiga antes de se iniciar o tratamento.
Ddavp® spray nasal
Devido à presença de cloreto de benzalcônio na fórmula, Ddavp® spray nasal pode causar broncoespasmo (contração da musculatura dos brônquios, causando dificuldade para respirar).
Efeito na capacidade de dirigir veículos e operar máquinas
Ddavp® não possui efeito na habilidade de dirigir veículos e operar máquinas.
Gravidez e lactação
Estudos limitados com mulheres grávidas que possuem diabetes insípídus e dados de mulheres grávidas com compliações hemorrágicas que utilizaram desmopressina indicam não haver efeitos adversos da desmopressina na gravidez ou na saúde do feto/recém-nascido. Não há dados epidemiológicos relevantes. Estudos de reprodução em animais não indicam efeitos nocivos diretos ou indiretos na gravidez, desenvolvimento fetal, parto e desenvolvimento pós-natal.
Devem ser tomadas precauções quando este medicamento for prescrito para grávidas.
Estudos de reprodução em animais não demonstraram efeitos clinicamente relevantes nos pais e na prole. A análise in vitro de modelos de cotilédone humano demonstrou que a desmopressina não sofre transporte placentário quando administrada em concentrações terapêuticas.
Resultados da análise do leite materno em lactantes recebendo altas doses de demopressina (300 mcg intranasal) demonstraram que a quantidade de desmopressina que pode ser transferida para a criança é menor do que a quantidade necessária para influenciar na diurese.
Este medicamento não deve ser utilizado por mulheres grávidas sem orientação médica ou do cirurgião-dentista.
A reação adversa mais grave com a desmopressina é a hiponatremia, a qual pode causar dor de cabeça, náusea, vômito, redução do sódio no sangue, ganho de peso, mal estar, dor abdominal, cãimbras musculares, tontura, confusão, perda da consciência e em casos mais severos convulsão e coma.
A hiponatremia é reversível e em crianças é comumente relacionada à alterações na rotina diária afetando a ingestão de líquidos e/ou perspiração (O álcool pode diminuir a resposta antidiurética de Ddavp®).
A maior parte dos outros efeitos adversos é reportada como não sérios.
As reações adversas mais comumente relatadas durante o tratamento são congestão nasal, aumento da temperatura corpórea e rinite. Outras reações comuns são dor de cabeça, infecção do trato respiratório superior, gastroenterite, dor abdominal. Reações anafiláticas não foram observadas em estudos clínicos, porém relatos espontâneos foram recebidos.
Frequência das reações adversas com base nos estudos clínicos realizados com Ddavp® solução e spray nasal:
- Reação muito comum (ocorre em mais de 10% dos pacientes que utilizam este medicamento): congestão nasal, rinite, aumento da temperatura corpórea;
- Reação comum (ocorre entre 1% e 10% dos pacientes que utilizam este medicamento): insônia, labilidade emocional, pesadelos, nervosismo, agressividade, dor de cabeça, sangramento nasal, infecções do trato respiratório superior, gastroenterite, dor abdominal, náusea;
- Reação incomum (ocorre entre 0,1% e 1% dos pacientes que utilizam este medicamento): hiponatremia (redução de sódio no sangue), vômito;
- Reações com frequência desconhecida: reações alérgicas, desidratação, confusão, convulsões, coma, tontura, sonolência, hipertensão, dispneia, diarreia, prurido, rash, urticária, espasmos musculares, fadiga, edema periférico, dor no peito, calafrios, ganho de peso.
Informe ao seu médico, cirurgião-dentista ou farmacêutico o aparecimento de reações indesejáveis pelo uso do medicamento. Informe também a empresa através do seu serviço de atendimento.
Crianças, idosos e pacientes com níveis de sódio no sangue abaixo do normal podem apresentar maior risco de hiponatremia (redução do sódio no sangue).
Devem ser tomadas precauções em pacientes com risco de aumento da pressão intracraniana.
O tratamento com desmopressina deve ser interrompido ou cuidadosamente ajustado durante doenças intercorrentes agudas caracterizadas por desequilíbrio de fluidos e/ou eletrólitos (como infecções sistêmicas, febre, gastroenterite).
Precauções para evitar a hiponatremia, incluindo atenção especial à ingestão de fluidos e maior frequencia do monitoramento de sódio no sangue, devem ser tomadas em caso de uso concomitante com drogas conhecidas por induzir a secreção de hormônio antidiurético, como antidepressivos tricíclicos, inibidores seletivos da recaptação de serotonina, clorpromazina, carbamazepina e alguns antidiabéticos do grupo das sulfonilureias, particularmente a clorpropamida, e em caso de tratamento com anti-inflamatórios não esteroidais.
Há certa evidência, de dados pós-comercialização, da ocorrência de hiponatremia severa associada à desmopressina em formulação nasal quando esta é utilizada para o tratamento de diabetes insípidus central.
Mudanças na mucosa nasal, como edema, ou outras doenças podem causar falha no tratamento, absorção insuficiente e, nestes casos, Ddavp® por via intranasal não deverá ser usado.
A dose de Ddavp® para crianças com diabetes insipidus deve ser cuidadosamente ajustada, de acordo com as necessidades e tolerância do paciente. O uso de Ddavp® em recém-nascidos e crianças requer cuidadosa restrição da ingestão de líquidos.
Spray nasal 0,1 mg/mL
Em embalagens com um frasco com pulverizador, contendo 2,5 mL de solução correspondente a 25 doses de 10 mcg.
Via intranasal.
Uso adulto e pediátrico.
Solução nasal 0,1mg/mL
Em embalagens com um frasco contendo 2,5 mL de solução correspondente a 25 doses de 10 mcg e duas cânulas (túbulos) graduadas para administração.
Via intranasal.
Uso adulto e pediátrico.
Cada mL de spray nasal contém:
0,1 mg de acetato de desmopressina (equivalente a 89 mcg de desmopressina).
Excipientes: cloreto de sódio, ácido cítrico monoidratado, fosfato de sódio dibásico diidratado, cloreto de benzalcônio e água purificada.
Cada mL de solução nasal contém:
0,1 mg de acetato de desmopressina (equivalente a 89 mcg de desmopressina).
Excipientes: clorobutanol, cloreto de sódio, ácido clorídrico e água purificada.
O excesso de Ddavp® pode causar a retenção de água e hiponatremia (diminuição da quantidade de sódio no sangue).
Embora o tratamento para hiponatremia seja individualizado, as seguintes recomendações gerais podem ser fornecidas:
- Descontinuar o tratamento com Ddavp®, restringir o volume de líquidos ingeridos e tratar os sintomas, se necessário.
Em caso de uso de grande quantidade deste medicamento, procure rapidamente socorro médico e leve a embalagem ou bula do medicamento, se possível. Ligue para 0800 722 6001, se você precisar de mais orientações.
Substâncias conhecidas como indutoras da síndrome de secreção inapropriada do hormônio antidiurético, como por exemplo antidepressivos tricíclicos, inibidores seletivos de recaptura de serotonina, clorpromazina e carbamazepina, assim como alguns medicamentos antidiabéticos do grupo das sulfonilureias (particularmente a clorpropamida) podem causar um efeito antidiurético com um aumento do risco de retenção de fluidos.
Anti-inflamatórios não esteroidais podem induzir a retenção de água/hiponatremia (diminuição da concentração de sódio no sangue).
O uso concomitante com cloridrato de loperamida pode resultar em um aumento em até três vezes na concentração plasmática de desmopressina, podendo levar a um aumento do risco de retenção de água ou hiponatremia. Embora ainda não estudado, outras drogas que diminuam o ritmo intestinal podem ter o mesmo efeito.
É improvável que a desmopressina interaja com outras drogas afetando o metabolismo hepático, uma vez que a desmopressina demonstrou, em estudos in vitro com microssomas humanos, não sofrer metabolismo hepático significativo. No entanto, estudos de interação in vivo não foram realizados.
Interações com alimentos e álcool
Não há dados sobre a interação com alimentos para as apresentações de administração pela via intranasal.
O álcool pode diminuir a resposta antidiurética da desmopressina.
Interações com exames laboratoriais
Não há dados a respeito das interações de Ddavp® spray nasal e Ddavp® solução nasal com exames laboratoriais.
Informe ao seu médico ou cirurgião-dentista se você está fazendo uso de algum outro medicamento.
Não use medicamento sem o conhecimento do seu médico. Pode ser perigoso para a sua saúde.
Resultados de Eficácia
Lactentes que apresentam deficiência de LAL
O LAL-CL03 foi um estudo multicêntrico, aberto e de braço único de Alfassebelipase em 9 pacientes com deficiência de LAL com falha no crescimento ou outros indícios de doença rapidamente progressiva antes dos 6 meses de idade. Os pacientes apresentavam também doença hepática rapidamente progressiva e hepatoesplenomegalia grave. A faixa etária para admissão no estudo era de 1-6 meses. Os pacientes receberam Alfassebelipase a 0,35 mg/kg uma vez por semana durante as primeiras 2 semanas e depois 1 mg/kg uma vez por semana. Com base na resposta clínica, o aumento progressivo da dose para 3 mg/kg uma vez por semana verificou-se logo ao fim de 1 mês e até 20 meses após o início do tratamento a 1 mg/kg. Foi permitido um aumento adicional progressivo da dose para 5 mg/kg uma vez por semana. A eficácia foi avaliada comparando a experiência de sobrevida de pacientes tratados com Alfassebelipase que sobreviveram por mais de 12 meses de idade no LAL-CL03 com um grupo histórico de lactentes não tratados que apresentavam deficiência de LAL com características clínicas semelhantes.
No LAL-CL03, 6 de 9 lactentes tratados com Alfassebelipase sobreviveram mais de 12 meses (67% de sobrevivência aos 12 meses, IC 95%: 30% a 93%). Com o tratamento continuado por mais de 12 meses de idade, 1 paciente adicional faleceu aos 15 meses de idade. No grupo histórico, 0 de 21 pacientes sobreviveu mais de 8 meses de idade (0% de sobrevivência aos 12 meses, IC 95%: 0% a 16%). Alfassebelipase em doses até 1 mg/kg uma vez por semana resultou em melhorias dos níveis de alanina aminotransferase (ALT) e aspartato aminotransferase (AST) e aumento de peso nas primeiras semanas de tratamento. Da linha basal até à semana 48, as reduções médias de ALT e AST foram -34,0 U/l e -44,5 U/l, respetivamente. O aumento progressivo da dose para 3 mg/kg uma vez por semana foi associado a melhorias adicionais no aumento de peso, linfadenopatia e albumina sérica. Da linha basal até à semana 48, o percentil de peso médio para a idade melhorou de 12,74% para 29,83% e os níveis médios de albumina sérica aumentaram de 26,7 g/l para 38,7 g/l. Um lactente foi tratado com 5 mg/kg uma vez por semana no LAL-CL03; não foram notificadas reações adversas novas com esta dose. Na ausência de mais dados clínicos, esta dose não é recomendada.
Crianças e adultos com deficiência de LAL
O LAL-CL02 foi um estudo multicêntrico, duplo cego e controlado por placebo em 66 crianças e adultos com deficiência de LAL. Os pacientes foram aleatorizados para receberem Alfassebelipase a uma dose de 1 mg/kg (n=36) ou placebo (n=30) uma vez de duas em duas semanas durante 20 semanas no período duplo cego. A faixa etária no momento da randomização era dos 4 aos 58 anos de idade (71% tinham < 18 anos de idade). Para a admissão no estudo, os pacientes tinham de apresentar níveis de ALT ≥1,5 vezes o limite superior do normal (LSN). A maioria dos pacientes (58%) tinha colesterol LDL > 190 mg/dl no momento da admissão no estudo e 24% dos pacientes com colesterol LDL > 190 mg/dl estavam tomando medicamentos para baixar os lípidos. Dos 32 pacientes que fizeram uma biópsia de fígado no momento da admissão no estudo, 100% tinham fibrose e 31% tinham cirrose. A faixa etária dos pacientes com indícios de cirrose na biópsia era dos 4 aos 21 anos de idade.
Foram avaliados os seguintes parâmetros de avaliação final:
Formalização da ALT, diminuição do colesterol LDL, diminuição do colesterol não HDL, normalização da AST, diminuição dos triglicérides, aumento do colesterol HDL, diminuição do teor de gordura no fígado avaliado por imagem por ressonância magnética - eco de gradiente multi-eco (MEGE-MRI) e melhoria da esteatose hepática medida por morfometria. Observou-se uma melhoria estatisticamente significativa em vários parâmetros de avaliação final no grupo tratado com Alfassebelipase em comparação com o grupo de placebo na conclusão do período de 20 semanas de duplo cego do estudo, como apresentado na Tabela 3. A redução absoluta do nível médio de ALT foi de - 57,9 U/l (-53%) no grupo tratado com Alfassebelipase e -6,7 U/l (-6%) no grupo de placebo.
Tabela 3: Parâmetros de avaliação final primários e secundários de eficácia no LALCL02
a Proporção de pacientes que atingiram a normalização definida como 34 ou 43 U/l, em função da idade e do sexo.
b Proporção de pacientes que atingiram a normalização definida como 34-59 U/l, em função da idade e do sexo. Avaliada em pacientes com valores anormais na linha basal (n=36 para o Alfassebelipase; n=29 para o placebo).
c Avaliado em pacientes com avaliações efetuadas por MEGE-MRI (n=32 para o Alfassebelipase; n=25 para o placebo).
d Os valores de P são do teste exato de Fisher para os parâmetros de avaliação final de normalização e do teste de soma de postos Wilcoxon para todos os outros parâmetros de avaliação final.
Estiveram disponíveis biópsias de fígado emparelhadas na linha basal e na semana 20 num subgrupo de pacientes (n=26). Dos pacientes com biópsias de fígado emparelhadas, 63% (10/16) dos pacientes tratados com Alfassebelipase melhoraram da esteatose hepática (pelo menos ≥ 5% de redução) medida por morfometria em comparação com 40% (4/10) dos pacientes a receber placebo. Esta diferença não foi estatisticamente significativa. Período aberto Sessenta e cinco de 66 pacientes entraram no período aberto (até 130 semanas) com uma dose de Alfassebelipase de 1 mg/kg uma vez de duas em duas semanas.
Nos pacientes que tinham recebido Alfassebelipase durante o período de duplo cego, as reduções dos níveis de ALT durante as primeiras 20 semanas de tratamento mantiveram-se e observaram-se melhorias adicionais nos parâmetros dos lípidos incluindo os níveis de colesterol LDL e de colesterol HDL. Quatro (4) de 65 pacientes no período aberto tiveram um aumento progressivo da dose para 3 mg/kg uma vez de duas em duas semanas com base na resposta clínica. Os pacientes que receberam placebo apresentaram níveis séricos persistentemente elevados de transaminases e níveis séricos anormais de lípidos durante o período de duplo cego. Consistente com o que foi observado nos pacientes tratados com Alfassebelipase durante o período de duplo cego, o início do tratamento com Alfassebelipase durante o período aberto produziu melhorias rápidas nos níveis de ALT e nos parâmetros dos lípidos incluindo os níveis de colesterol LDL e de colesterol HDL. Num estudo aberto separado (LAL-CL01/LAL-CL04) em pacientes adultos com deficiência de LAL, as melhorias nos níveis séricos de transaminases e lípidos foram sustentadas durante o período de tratamento de 104 semanas.
População pediátrica
Cinquenta e seis de 84 pacientes (67%) que receberam Alfassebelipase durante os estudos clínicos (LAL-CL01/LAL-CL04, LAL-CL02 e LAL-CL03) pertenciam à faixa etária pediátrica e adolescente (1 mês até 18 anos de idade).
Características Farmacológicas
Propriedades farmacodinâmicas
Grupo farmacoterapêutico: Outros produtos do trato alimentar e metabolismo, enzimas; código ATC: A16AB14.
Deficiência de lipase ácida lisossomal (LAL)
A deficiência de LAL é uma doença rara associada a morbidade e mortalidade significativas, que afeta indivíduos desde a infância até à idade adulta. A deficiência de LAL nos lactentes é uma emergência médica com rápida progressão da doença ao longo de um período de semanas, tipicamente fatal nos primeiros 6 meses de vida. A deficiência de LAL é uma doença autossômica recessiva de armazenamento lisossomal caracterizada por um defeito genético que resulta numa diminuição acentuada ou perda de atividade da enzima lipase ácida lisossomal (LAL). A atividade deficiente da enzima LAL resulta no acúmulo lisossomal de ésteres do colesterol e triglicérides.
No fígado, este acúmulo conduz a hepatomegalia, teor de gordura no fígado aumentado, elevação das transaminases indicativo de lesão crônica do fígado e progressão para fibrose, cirrose e complicações de doença hepática em fase terminal. No baço, a deficiência de LAL resulta em esplenomegalia, anemia e trombocitopenia. O acúmlo de lípidos na parede do intestino conduz a má absorção e falha no crescimento. A dislipidemia é frequente com o LDL e os triglicérides elevados e o HDL baixo, associados ao teor de gordura aumentado no fígado e às elevações das transaminases. Além da doença hepática, os pacientes com deficiência de LAL têm um risco aumentado de doença cardiovascular e aterosclerose acelerada.
Mecanismo de ação
A Alfassebelipase é uma lipase ácida lisossomal humana recombinante (rhLAL). A Alfassebelipase liga-se aos recetores da superfície celular através de glicanos expressos na proteína e é subsequentemente internalizada nos lisossomas. A Alfassebelipase catalisa a hidrólise lisossomal dos ésteres do colesterol e triglicérides para colesterol livre, glicerol e ácidos graxos livres. A substituição da atividade da enzima LAL conduz a reduções do teor de gordura no fígado e das transaminases, e ativa o metabolismo dos ésteres do colesterol e triglicérides no lisossoma, conduzindo a reduções do colesterol de lipoproteínas de baixa densidade (LDL) e do colesterol de lipoproteínas não de alta densidade, triglicérides e aumentos do colesterol HDL. A melhoria do crescimento ocorre em resultado da redução de substratos no intestino.
Propriedades farmacocinéticas
Crianças e adultos
A farmacocinética da Alfassebelipase em crianças e adultos foi determinada utilizando uma análise farmacocinética da população de 65 pacientes com deficiência de LAL que receberam infusões intravenosas de Alfassebelipase a 1 mg/kg uma vez de duas em duas semanas no LAL-CL02. Vinte e quatro pacientes tinham idades compreendidas entre os 4 e os 11 anos, 23 tinham idades compreendidas entre os 12 e os 17 anos, e 18 tinham idade ≥ 18 anos (Tabela 4). Com base numa análise não compartimental de dados de adultos (LAL-CL01/LAL-CL-04), a farmacocinética da Alfassebelipase pareceu ser não linear com um aumento da exposição mais acentuado do que o proporcional à dose observado entre as doses de 1 e 3 mg/kg. Não se observou acúmulo a 1 mg/kg (uma vez por semana ou uma vez de duas em duas semanas) ou 3 mg/kg uma vez por semana.
Tabela 4: Parâmetros farmacocinéticos médios da população
* Semana 22 para os pacientes a receber placebo reinicializada para Semana 0, isto é, primeira semana de tratamento ativo.
AUCss = Área sob a curva de concentração plasmática-tempo em estado estacionário.
Cmax = Concentração máxima.
Tmax = Tempo até à concentração máxima.
CL = Depuração.
Vc = Volume central de distribuição.
T½ = Semivida.
Lactentes (< 6 meses de idade)
No LAL-CL03, a Alfassebelipase foi eliminada da circulação sistêmica com um T½ mediana de 0,1 h (intervalo: 0,1-0,2) à dose de 3 mg/kg uma vez por semana (n = 4). A diferença em exposições à Alfassebelipase entre os grupos que receberam 0,35 mg/kg e 3 mg/kg uma vez por semana foi mais do que proporcional à dose, com um aumento de 8,6 vezes da dose, resultando num aumento de 9,6 vezes da exposição para a AUC e um aumento de 10,0 vezes para a Cmax.
Linearidade/não linearidade
Com base nestes dados, a farmacocinética da Alfassebelipase pareceu ser não linear com um aumento da exposição mais acentuado do que o proporcional à dose observado entre as doses de 1 e 3 mg/kg.
Populações especiais
Durante a análise de covariáveis do modelo de farmacocinética da população para a Alfassebelipase, constatou-se que a idade, o peso corporal e o sexo não tinham uma influência significativa na CL e no Vc da Alfassebelipase. A Alfassebelipase não foi investigada em pacientes com idades compreendidas entre os 2 e os 4 anos ou em pacientes com idade igual ou superior a 65 anos. As informações sobre a farmacocinética da Alfassebelipase em grupos étnicos não caucasianos são limitadas. A Alfassebelipase é uma proteína e prevê-se que seja metabolicamente degradada através de hidrólise péptica. Consequentemente, não se prevê que a função hepática comprometida afete a farmacocinética da Alfassebelipase.
Para os pacientes com comprometimento hepático grave existe falta de dados. A eliminação renal da Alfassebelipase é considerada uma via menor para a depuração. Para os pacientes com comprometimento renal existe falta de dados. As informações sobre o impacto de anticorpos antifármaco na farmacocinética da Alfassebelipase são limitadas.
Ddavp® spray nasal deve ser conservado em temperatura ambiente (entre 15°C e 30°C).
Ddavp® solução nasal deve ser conservado sob refrigeração (temperatura entre 2 e 8ºC).
Número de lote e datas de fabricação e validade: vide embalagem.
Não use medicamento com o prazo de validade vencido. Guarde-o em sua embalagem original.
Após aberto, o frasco de Ddavp® solução nasal e spray nasal são válidos por 2 meses.
Aspecto físico
Spray nasal
- Frasco de vidro âmbar equipado com um conjunto de bomba de pré-compressão, incluindo-se bomba, aplicador nasal e tampa protetora.
- Solução transparente incolor.
- Volume nominal de 2,5 mL.
Solução nasal
- Frasco de vidro âmbar com gotejador.
- Duas cânulas (túbulos) de plástico graduado.
- Solução clara e incolor.
- Volume nominal de 2,5 mL.
Antes de usar, observe o aspecto do medicamento. Caso ele esteja no prazo de validade e você observe alguma mudança no aspecto, consulte o farmacêutico para saber se poderá utilizá-lo.
Todo medicamento deve ser mantido fora do alcance das crianças.
Solicitamos a gentileza de ler cuidadosamente as informações abaixo. Caso não esteja seguro a respeito de determinado item, favor informar ao seu médico.
M.S - 1.2876.0015
Farm. Resp.:
Silvia Takahashi Viana
CRF/SP 38.932
Fabricado por:
Ferring GmbH
Kiel, Alemanha
Embalado por:
Ferring International Center SA – FICSA
St. Prex, Suíça
Importado comercializado e registrado por:
Laboratórios Ferring Ltda.
Praça São Marcos, 624
05455-050 - São Paulo - SP
CNPJ: 74.232.034/0001-48
SAC
0800 772 4656
Venda sob prescrição médica.
Especificações sobre o Ddavp
Caracteristicas Principais
Fabricante:
Necessita de Receita:
Branca Comum (Venda Sob Prescrição Médica)
Principio Ativo:
Categoria do Medicamento:
Classe Terapêutica:
Especialidades:
Urologia
Endocrinologia
Doenças Relacionadas:
Bula do Paciente:
Bula do Profissional:
DDAVP É UM MEDICAMENTO. SEU USO PODE TRAZER RISCOS. PROCURE UM MÉDICO OU UM FARMACÊUTICO. LEIA A BULA. MEDICAMENTOS PODEM CAUSAR EFEITOS INDESEJADOS. EVITE A AUTOMEDICAÇÃO: INFORME-SE COM SEU MÉDICO OU FARMACÊUTICO.
Descubra a Melhor Opção de Ddavp para Você
Compare e escolha entre variações com facilidade
| Ddavp 0,1mg/mL, caixa com 1 frasco spray com 2,5mL de solução de uso nasal | Ddavp 0,1mg/mL, caixa com 1 frasco com 2,5mL de solução de uso nasal + 2 aplicadores | |
Dose | 0.1mg/mL | 0.1mg/mL |
Forma Farmacêutica | Solução nasal | Solução nasal |
Quantidade na embalagem | 2.5 mL | 2.5 mL |
Modo de uso | Uso nasal | Uso nasal |
Substância ativa | Alfassebelipase | Alfassebelipase |
Preço Máximo ao Consumidor/SP | R$ 392,74 | R$ 392,74 |
Preço de Fábrica/SP | R$ 284,09 | R$ 284,09 |
Tipo do Medicamento | Novo | Novo |
Pode partir? | Este medicamento não pode ser partido | Este medicamento não pode ser partido |
Registro Anvisa | 1287600150058 | 1287600150031 |
Precisa de receita | Sim, precisa de receita | Sim, precisa de receita |
Tipo da Receita | Branca Comum (Venda Sob Prescrição Médica) | Branca Comum (Venda Sob Prescrição Médica) |
Código de Barras | 7896165600024 | 7896165600017 |